
题目列表(包括答案和解析)
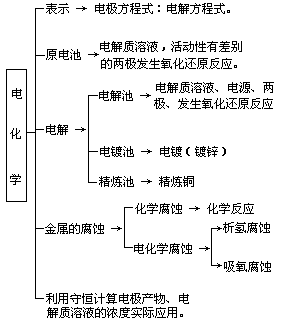
3.原电池、电解池、电镀池的判
断规律
(1)若无外接电源,可能是原电池,依据原电池的形成条件判断,主要有“三看”。
[设问]看什么呢?
回答:
看电极;看溶液;看回路。
[投影]
先看电极:两极为导体且活泼性不同,有一个先发生化学反应。
再看溶液:两极插入电解质溶液中。
[设问]
这样就可以形成电池了吗?
回答:
不能。
对,还应该看回路:形成闭合回路或者两极板相接触。
[设问]
若有外接电源,两极插入电解质溶液,并有回路,可能是什么池?
回答:
是电解池。
[评价]不完全正确。(纠正后看投影)
(2)若有外接电源,两极插入电解质溶液,可能是电解池或者是电镀池。
[设问]为什么呢?
回答:
当阳极金属与电解质溶液中的阳离子相同时,则为电镀池,其余的情况是电解池。
[评价]很好,根据电解液、根据阳极的电极材料,确定电解或电镀。
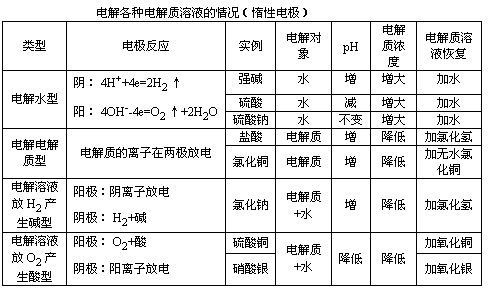
2.分析电解应用的主要方法和思路
[设问]
电解质在通电前、通电后的关键点是什么呢?
在电解时离子的放电规律是什么呢?
电解的结果:溶液的浓度、酸碱性有无变化?
回答:
通电前:电解质溶液的电离(它包括了电解质的电离也包括了水的电离)。
通电后:离子才有定向的移动(阴离子移向阳极,阳离子移向阴极)。
放电规律:
阳极:
金属阳极>S2->I->Cl->OH->含氧酸根
阴极:
Ag+>Cu2+>Pb2+>Fe2+>Zn2+>H+>Mg2+
溶液的离子浓度可能发生变化如:电解氯化铜、盐酸等离子浓度发生了变化。
因为溶液中的氢离子或氢氧根离子放电,所以酸碱性可能发生改变。
请同学们看下列的归纳表格。
[设问]
电化学中有哪些知识点是重点要掌握的呢?
学生活动
回答:
原电池与电解池的不同点;原电池的工作原理以及电解池的工作原理;两极反应的判断和书写;电化学的应用。
很好,我们可以将电化学的知识归纳在网络图中,哪一个同学能够写出?
[投影]知识点的归纳,网络图
学生打出投影:
1.常见的电池
[设问]
①构成原电池的材料是什么呢?
②原电池的原理是什么呢?
③它的原理与电解池有什么不同?
④常见的电池的类型?
看录像或投影:
回答:
①原电池是由金属与金属或非金属,电解质溶液构成的。
②原电池是由化学能转化为电能的装置。
③它的原理与电解池不同,因为电解池是由电能转化为化学能的装置。
④常见的电池有:干电池;蓄电池。
几种电池示意图:
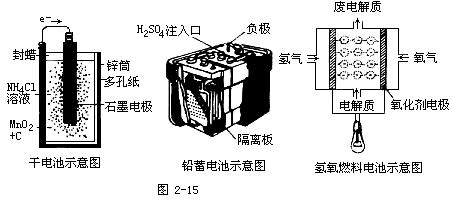
[设问]
根据示意图你能说明电池的种类吗?
回答:
锌锰电池(干电池)、铅蓄电池、燃烧电池(氢氧燃烧电池、甲烷燃烧电池)等。
[设问]
①电池的两极各发生了什么反应?
②电池正、负两极应该如何确定?
它的两极与电解池的两极有什么不同点?
③在可逆电池中,充电、放电过程是应用了原电池的原理还是电解池的原理?
回答:
①活泼的金属为负极,发生氧化反应。
不活泼的金属为正极,发生还原反应。
②原电池与电解池的两极不相同,表现在:原电池活泼金属是负极,而电解池与电源负极相互联结的就是负极(阴极)。
原电池两极金属的金属活动性必须不同,而电解池两极可以是惰性电极,也可以是金属电极。
③放电的过程是应用了原电池的原理,而充电过程应用了电解池的原理。
[讲解]
电池可以分为可逆电池和不可逆电池,比如:干电池、燃烧电池等都是不可逆电池,它们在发生反应时有气体或生成的物质无法在相同的条件下返回,所以,称为不可逆电池。
[设问1]
请举例说明不可逆电池(展示学生解剖的干电池)?
干电池的两极材料是什么?
电解质溶液是什么?
两极反应式如何书写?
总反应如何书写?
回答1:
如:锌-锰电池
两极材料是Zn、MnO2
电解质溶液是:NH4Cl
负极:Zn-2e=Zn2+
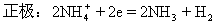
总反应:Zn+2NH4=Zn2++2NH3↑+2H2↑
[评价]纠正学生的错误,写出正确的反应。
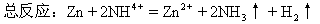
[设问2]
还有什么实例呢?
两极材料是什么呢?
电解质溶液是什么呢?
回答2:
再如:锌-铜电池,负极-Zn,正极-Cu。
负极:Zn-2e=Zn2+,电解质溶液--稀硫酸。
正极:2H++2e=2H=H2
总反应:2H++Zn=H2↑+Zn2+
什么是可逆电池呢?(看前面的图)
谁能写出两极反应式?
总反应式又如何书写呢?
(教师指导学生书写)
铅蓄电池是可逆电池
两极反应式:
负极:Pb-2e=Pb2+
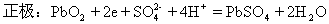
总反应:
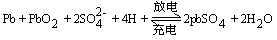
[练习]
书写两极反应式。
若有:
(1)铜、锌、稀硫酸
(2)铜、铁在潮湿的空气中的腐蚀
(3)锌、铁放在食盐水中
(4)氢、氧燃烧电池(电池的产物负极为H2O,正极则有大量的氢氧根生成)
(5)甲烷燃烧电池(电池负极甲烷燃烧失去电子,在碱性条件下

根据信息写出(4)、(5)的电池总反应式。
板演:
(1)负极:Zn-2e=Zn2+
正极:2H++2e=2H=H2
(2)负极:2Fe-4e=2Fe2+
正极:O2+4e+2H2O=4OH-
(3)负极:2Zn-4e=2Zn2+
正极:O2+4e+2H2O=4OH-
(4)负极:2H2+4OH--4e=4H2O
正极:O2+4e+2H2O=4OH-
总反应:2H2+O2=2H2O</PGN0097.TXT/PGN>
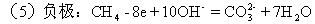
正极:2O2+8e+4H2O=8OH-
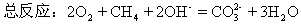
[设问]
谁能够将燃烧电池小结一下呢?
回答:
在燃烧电池反应中确定哪一极发生的是什么反应的关键是:
负极发生氧化反应,化合价升高,失去电子;
总反应式为:两极反应的加合;
书写反应时,还应该注意得失电子数目应该守恒。
[评价]回答的很好。
燃烧电池反应中确定哪一极发生的是什么反应的关键是:
负极:化合价升高,失去电子,发生氧化反应;
正极:化合价降低,得到电子发生还原反应。
14.(06年湖南长沙) 1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程中,能直接表示出氯化钠晶体格能的是 。
A.Na+(g) + Cl-(g) → NaCl(s); △Q
B.Na(s) + 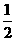 Cl2(g) → NaCl(s);△Q1
Cl2(g) → NaCl(s);△Q1
C.Na(s) → Na(g); △Q2
D.Na(g)-e-→ Na+(g); △Q3
E.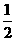 Cl2(g) → Cl(g);△Q4
Cl2(g) → Cl(g);△Q4
F.Cl(g) + e-→ Cl-(g);△Q5
(2)写出△Q1与△Q、△Q2、△Q3、△Q4、△Q5之间的关系式 。
(3)若氧化亚铁晶体结构氯化钠晶体结构相似,则:氧化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子个数是 。
(4)若氧化亚铁晶体中有3 n个二价铁离子被2 n个三价铁离子所替代,该晶体中氧离子的数目将______ (填“减少”、“增多”或“保持不变”)。
答案:(1)A; (2)ΔQ1 = ΔQ+ΔQ2+ΔQ3+ΔQ4+ΔQ5 ; (3)6; (4)保持不变。
解析:(1)根据“1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能”, Na+(g) + Cl-(g) → NaCl(s)中的反应热△Q就能直接表示出氯化钠晶体格能;
(2) Na(s)+
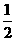 Cl2(g) → NaCl(s)可以看作是由以下几个过程组成:
Cl2(g) → NaCl(s)可以看作是由以下几个过程组成:
Na(s)
→ Na(g)→ Na+(g),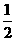 Cl2(g) → Cl(g)→
Cl-(g),Na+(g) + Cl-(g) → NaCl(s)。根据“盖斯定律”, ΔQ1=ΔQ+ΔQ2+ΔQ3+ΔQ4+ΔQ5。
Cl2(g) → Cl(g)→
Cl-(g),Na+(g) + Cl-(g) → NaCl(s)。根据“盖斯定律”, ΔQ1=ΔQ+ΔQ2+ΔQ3+ΔQ4+ΔQ5。
(3) 氯化钠晶体是正六面体结构,晶体中每个氯离子周围有6个钠离子,每个钠离子周围有6个氯离子。氧化亚铁晶体结构氯化钠晶体结构相似,因此,每个Fe2+周围有6个O2-,每个O2-周围有6个Fe2+。
(4)根据电荷守恒,3n个Fe2+和2n个Fe3+所带电荷数相等,若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,晶体中氧离子的数目将不变。
评价:此题以氯化钠晶体为例,考查了有关“晶体结构”的知识;以求氯化钠的晶格能为例,考查了“盖斯定律”的运用,属于难题。
13.(06年安徽宿迁)在化学反应中,只有
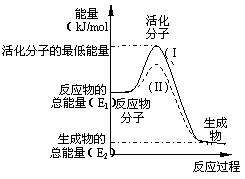 极少数能量比平均能量高得多的反应物分子发生
极少数能量比平均能量高得多的反应物分子发生
碰撞时才可能发生化学反应,这些分子被称为活
化分子。使普通分子变成活化分子所需提供的最
低限度的能量叫活化能,其单位通常用kJ·mol-1
表示。请认真观察右图,然后回答问题。
(1)图中所示反应是________(填“吸热”
或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________
(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+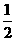 O2(g) = H2O(g) △H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g) = H2O(g) △H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
答案:(1)放热; 需要; -(E1 - E2) kJ·mol-1
(2)409 kJ·mol-1; (3)使用了催化剂。
解析:(1)据图可知,反应物的总能量高于生成物的总能量,该反应是放热反应,反应热为:△H = -(E1 - E2) kJ·mol-1;由于反应物的总能量低于活化分子的最低能量,因此反应需要加热。
(2)由图可知,在反应H2(g)+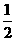 O2(g)= H2O(g) △H = - 241.8 kJ·mol-1中,活化分子的最低能量比反应物分子的能量高241.8 kJ·mol-1;该反应是放热反应,反应物分子的能量又比生成物分子的能量高167.2 kJ·mol-1,因此活化分子的最低能量比生成物分子的能量高(241.8 +167.2) kJ·mol-1=409 kJ·mol-1;逆过程是吸热反应;活化能高于原反应的活化能,应等于原反应中活化分子的最低能量与生成物分子的能量差,即409 kJ·mol-1。
O2(g)= H2O(g) △H = - 241.8 kJ·mol-1中,活化分子的最低能量比反应物分子的能量高241.8 kJ·mol-1;该反应是放热反应,反应物分子的能量又比生成物分子的能量高167.2 kJ·mol-1,因此活化分子的最低能量比生成物分子的能量高(241.8 +167.2) kJ·mol-1=409 kJ·mol-1;逆过程是吸热反应;活化能高于原反应的活化能,应等于原反应中活化分子的最低能量与生成物分子的能量差,即409 kJ·mol-1。
(3)催化剂在化学反应中起催化作用的原理是:加入催化剂,改变了反应历程,降低了反应的活化能,因此,降低反应活化能的唯一途径是使用催化剂。
评价:本题利用图象的形式,旨在考查对“化学反应中的能量变化”的判断与有关化学反应中“活化能”的计算,在理论上有深度,属于难题。
12.(06年东阳)已知:2 H2(g) + O2(g) = 2 H2O(g) △H1;
2 H2(g) + O2(g) = 2 H2O(l) △H2;
2 CO(g) + O2(g) = 2 CO2(g) △H3。
⑴ 写出液态水转化为气态水的热化学方程式 。
⑵ CO和H 2分别燃烧生成CO2(g)和H 2O(g),欲得到相同热量,所需CO和H 2的体积比是 。
答案: ⑴ H2O(l)
= H2O(g);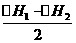 ⑵
⑵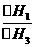
解析:⑴ 2 H2(g) + O2(g) = 2 H2O(l)可以看作由以下两个过程组成:
2 H2(g) + O2(g) = 2 H2O(g) △H1;
H2O(l) = H2O(g) (焓变设为△Hx);
根据“盖斯定律”, △H2 = △H1
+△Hx ,△Hx
= 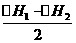 。
。
⑵根据2
H2(g) + O2(g ) = 2 H2O (g) (△H1), 2 CO(g) + O2(g) = 2 CO2(g)
(△H3)可知:欲得到相同热量,所需CO和H
2的物质的量之比等于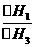 ,同温同压下,二者体积比等于物质的量之比,等于
,同温同压下,二者体积比等于物质的量之比,等于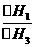 。
。
评价:此题旨在考查“盖斯定律”的运用和有关“燃烧热”的计算,属于中等难度题。
11.(06年广东深圳)1840年前后,俄国科学家盖斯(Hess)指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”。现已知,在101 KPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.83 kJ·mol-1、285.83 kJ·mol-1和393.51 kJ·mol-1,则反应C(s) + 2 H2(g) = CH4(g)的反应热△H =____,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义_________________________。
答案:△H = - 74.81 kJ·mol-1;对于一些很难用实验方法直接测定热量的化学反应的反应热可以用“盖斯定理”间接测定。
解析:CH4(g)、H2(g)、C(s)在101 KPa下燃烧的热化学方程式分别为:
① CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l),ΔH1= -890.36 kJ·mol-1
② H2(g) +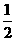 O2(g) = 2 H2O(l),ΔH2
= -285.83 kJ·mol-1
O2(g) = 2 H2O(l),ΔH2
= -285.83 kJ·mol-1
③ C(s) + O2(g) = CO2(g),ΔH3 = -393.51 kJ·mol-1
根据“盖斯定理”,③ + ② × 2 - ① 得:
④ C(s) + 2 H2(g) = CH4(g),ΔH = ΔH3 + 2 ΔH2–ΔH1 = -74.81 kJ·mol-1
评价:此题旨在考查“盖斯定理”的运用,属于容易题。
10.(06年江苏东海)工业由粗硅制取纯硅有以下反应:
①Si(s) + 3 HCl(g) SiHCl3(g) + H2(g);△H = -318 kJ·mol-l
SiHCl3(g) + H2(g);△H = -318 kJ·mol-l
②SiHCl3(g) + H2(g)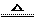 Si(s) + 3 HCl(g);
Si(s) + 3 HCl(g);
下列关于上述反应的说法中不正确的是
A.反应①、②均为氧化还原反应 B.反应①、②均为置换反应
C.若反应①放热,则反应②一定吸热 D.欲提高SiHCl3产率,可减压或升温
答案:D。
解析:从化学反应的形式来看,反应①、②均为置换反应,都属于氧化还原反应,A、B两项的结论都对;反应①、②互为逆过程,反应①放热,则反应②一定吸热,C项结论正确;反应①既是放热反应,又是气体体积缩小的反应,欲提高SiHCl3产率,根据平衡移动原理,应采取减压或降温的措施,D项结论错误。
评价:此题旨在考查对“化学反应类型”、“化学反应中的能量变化”的相关知识的掌握以及“平衡移动原理”的应用,属于中等难度题。
9.(06年广东惠州)根据热化学方程式:S(s) + O2(g)= SO2(g) △H = -297.23 kJ·mol-1,下列说法正确的是:
A.1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和
B.1 mol SO2(g)的能量总和小于1 mol S(s)和1 mol O2(g)的能量总和
C.S(g) + O2(g) = SO2(g) △H = -Q kJ·mol-1;Q的值大于297.23
D.S(g) + O2(g)= SO2(g) △H = -Q kJ·mol-1;Q的值等于297.23
答案:BC。
解析:S(s) + O2(g)= SO2(g) △H = -297.23 kJ·mol-1是表示S的燃烧热的热化学方程式。根据“放热反应的实质是反应物的总能量高于生成物的总能量”可知,1 mol SO2(g)的能量总和小于1 mol S(s)和1 mol O2(g)的能量总和,则A项正确,B项错误;根据“盖斯定律”,S(s) + O2(g)=SO2(g)可以看作是通过“S(s)= S(g)(此过程是吸热的,设焓变为△H1,则△H1>0) ”与“S(g) + O2(g) = SO2(g)(△H = -Q kJ·mol-1)”两个过程实现,反应热等于两个过程的热效应的叠加,即:- 297.23 kJ·mol-1 = -Q kJ·mol-1+△H1,则:Q > 297.23。
评价:此题以硫的燃烧热为例,旨在考查对“热化学方程式的意义”的理解、对“燃烧热”概念的掌握和“盖斯定律”的运用,属于中等难度题。
7.(06年南开中学)已知31 g 白磷变成红磷放出 18.39 kJ 热量,下列两反应中:
P4(s)+ 5 O2(g)= 2 P2O5(s),△H = Q1 kJ·mol-1
4 P(红,s)+ 5 O2(g)= 2 P2O5 (s),△H = Q2 kJ·mol-1
则下列说法中正确的是( )
A.Q1 > Q2,白磷比红磷稳定 B.Q1 > Q2,红磷比白磷稳定
C.Q1 < Q2,白磷比红磷稳定 D.Q1 < Q2,红磷比白磷稳定
答案:D。
解析:根据白磷变成红磷放出 18.39 kJ热量可知,白磷所含的能量高,红磷所含的能量低,红磷比白磷稳定;红磷转化为白磷的反应是吸热反应。根据“盖斯定律”,将两方程式叠加得:P4(s) = 4 P(红,s),△H =(Q1 - Q2)kJ·mol-1<0,因此Q1<Q2。
评价:此题旨在考查对“放热反应”概念的理解和对“盖斯定律” 在化学反应中有关反应热的计算中的运用,属于中等难度题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com