
题目列表(包括答案和解析)
17.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+χOH- Fe3O4+S4O62-+2H2O,下列说法中,正确的是:
A.χ=2
B.参加反应的Fe2+全部做还原剂
C.每生成1mol Fe3O4,反应转移的电子总数为4mol
D.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
16.下列离子方程式中,正确的是:
A.碳酸氢钠溶液与稀硫酸混合:CO32-+2H+=CO2↑+H2O
B.大理石溶于醋酸:CaCO3+2H+=Ca2++ CO2↑+H2O
C.CO2气体通人CaCl2溶液中:Ca2++ CO2+H2O ==CaCO3↓+2H+
D.稀H2SO4和Ba(OH)2溶液反应:2H++SO +Ba2++2OH-=BaSO4↓ +2H2O
+Ba2++2OH-=BaSO4↓ +2H2O
15.某温度下,在体积一定的密闭容器中适量的NH3和Cl2恰好完全反应。若反应产物只有N2和NH4Cl固体,则反应前后容器中的压强比接近于:
A、1:11 B、11:1 C、7:11 D、11:7
14.对某无色溶液中所含阴离子进行鉴别,根据实验事实所得出的相应结论正确的是:
|
|
实验事实 |
结论 |
|
A |
加入AgNO3溶液生成白色沉淀,加稀盐酸沉淀不消失 |
一定有Cl- |
|
B |
通人CO2生成白色沉淀,CO2过量沉淀也不消失 |
一定有A1O2- |
|
C |
通人Cl2后溶液变为黄色,加入淀粉溶液后溶液变蓝 |
一定有I- |
|
D |
加入紫色石蕊试液,溶液变红色 |
一定有OH- |
13.测得某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子, 其中Na+与Mg2+的个数比为4∶5, 则Cl-和SO42-的个数比为
①8∶3 ②3∶2 ③4∶1 ④1∶3
A.只有① B.只有①②④ C.只有②④ D.①②③④
12.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能够说明这个结论的是:
A.已经制得了 IBr、ICl 等卤素互化物
B.已经制得 I2O5 等碘的氧化物
C.已经制得了I(NO3)3、I(ClO4)3·2H2O等含 I3+ 离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3- 离子
11.下列关于热化学反应的描述中正确的是:
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的
ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
10.室温下,等体积的NO和O2混合,混合气体的平均相对分子质量是:
A.31 B.41.3 C.稍大于41.3 D.稍小于41.3
9.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l) = Zn(OH)2(s)+Mn2O3(s),下列说法错误的是:
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
8.设阿伏加德罗常数为NA。则下列说法正确的是:
A.常温常压下,6 g 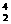 He所含有的中子数目为2NA
He所含有的中子数目为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com