
题目列表(包括答案和解析)
6. 体积为V mL,密度为ρ g·cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol·L-1,质量分数为w%,下列表示式正确的是( B )
A. c=1000Vρ B. m=Vρ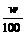 C. w%=
C. w%=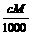 % D. c=
% D. c=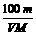
5. 阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是( B )
A. 标准状况下,2.24 L苯中约含有3.612×1024个碳原子
B. 常温常压下,氧气和臭氧的混合物16 g中约含有6.02×1023个氧原子
C. 25 ℃时,l L pH=13的氢氧化钠溶液中约含有6.02×1023个个氢氧根离子
D. 标准状况下11.2 L CH4中约含有3.01×1024个原子
4. 4 ℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为(NA表示阿伏加德罗常数的值)( B )
A. 20NA B. NA/360 C. 9NA/10 D. 360/NA
3. 20 g AO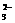 中核外电子数比质子数多0.5NA(NA代表阿伏加德罗常数)个,则元素A的相对原子质量为( B )
中核外电子数比质子数多0.5NA(NA代表阿伏加德罗常数)个,则元素A的相对原子质量为( B )
A. 12 B. 32 C. 60 D. 80
2. 下列溶剂能溶解单质碘和溴,但不能把碘和溴从碘水和溴水中萃取出来的是( D )
A. 汽油 B. 苯 C. 四氯化碳 D. 酒精
[解析] 萃取剂选择三原则①萃取剂和原溶液中的溶剂互不相溶②溶质在其中的溶解度较大③萃取后溶质和萃取剂容易分离。酒精易溶于水,不能分层。
1. 下列物质的保存方法,正确的是( C )
A. 保存液溴时,加少量水密封,敞口置于空气中
B. 氢氟酸保存在棕色玻璃试剂瓶中
C. 液氯密闭保存在干燥的钢瓶中
D. 新制氯水通常保存在无色试剂瓶中
24.(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
Z+W
(1)Y的电子式是 _。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是 。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
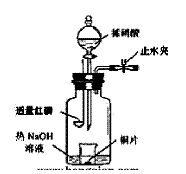 b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分
液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作
是 。
②红磷充分燃烧的产物与NaOH溶
液反应的离子方程式是 。
③步骤c滴入稀硝酸后烧杯中的现
象是 。反应的离子
方程式是 。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
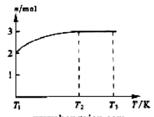 ①温度在T1-T2之间,反应的化学方程式是
。
①温度在T1-T2之间,反应的化学方程式是
。
②温度在T2-T3之间,气体的平均相对分子质量
是(保留1位小数) 。
23.(15分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式是 ;X与碳元素形成的化合物的电子式是 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,写出其氢化物能用于蚀玻璃时主要反应方程式为 。
22.(14分)实验室制中备少量硫酸亚铁晶体的实验步骤如下:
取废铁悄放入碳酸钠溶液中加热,用蒸馏水把铁屑冲洗干净,取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热仍有少量铁屑。将该溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置,冷却时间后收集产品。
(1)废铁悄放入碳酸钠溶液中加热目的 。
(2)硫酸溶液过稀会导致 。
(3)采用水浴加热的原因是 。温试控制到50℃-80℃原因 。
(4)反应时铁屑过量的目的是(用离子方程式表示) 。
(5)溶液趁热时过滤的原因是 。
(6)静置冷却一段时间后,在试管中观察到的现象是 。
21. (14分)某无色溶液,其中有可能存在离子如下:Na+、Ba2+、AlO3+、A1O2-、S2-、SO
(14分)某无色溶液,其中有可能存在离子如下:Na+、Ba2+、AlO3+、A1O2-、S2-、SO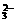 、SO
、SO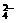 。现取该溶液进行有关实验,实验结果如下图所示。
。现取该溶液进行有关实验,实验结果如下图所示。
请回答下列问题:
(1)沉淀甲是 ;
(2)沉淀乙是 由溶液甲生成沉淀乙的离子方程式为:
;
(3)沉淀丙是 ;
(4)写出生成甲的离子方程式
(5)综合上述信息,、可以肯定存在的离子 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com