
题目列表(包括答案和解析)
24. (12分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1) 一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g) +2B(g)  4C (g) △H >0 达到平衡时,c(A) =2 mol·L-1,c ( B) = 7 mol·L-1,c ( C) = 4 mol·L-1。试确定B的起始浓度c
(B)的取值范围是
;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是
。
4C (g) △H >0 达到平衡时,c(A) =2 mol·L-1,c ( B) = 7 mol·L-1,c ( C) = 4 mol·L-1。试确定B的起始浓度c
(B)的取值范围是
;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是
。
A. 增加C的物质的量 B. 加压 C. 升温 D. 使用催化剂
 (2) 常温下,取
pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是
( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为
m2。 则
m1
m2 ( 选填“<”、“=”、“>”)
(2) 常温下,取
pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是
( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为
m2。 则
m1
m2 ( 选填“<”、“=”、“>”)
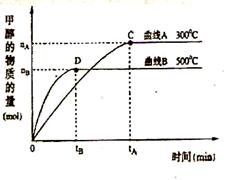 (3) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值
(3) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值
(填“增大”、“减小”或“不变”)。在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(4) 难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数。例如: Cu(OH)2(s) Cu2+
(aq) + 2OH - ( aq),Ksp
= c (Cu2+ ) [ c (OH - ) ]2 = 2×10 -20。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。若某CuSO4溶液里c( Cu2+) =0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于 ; 要使0.2 mol·L-1的CuSO4 溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为
。
Cu2+
(aq) + 2OH - ( aq),Ksp
= c (Cu2+ ) [ c (OH - ) ]2 = 2×10 -20。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。若某CuSO4溶液里c( Cu2+) =0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于 ; 要使0.2 mol·L-1的CuSO4 溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为
。
(5) 常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
。
23.(10分)将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

|
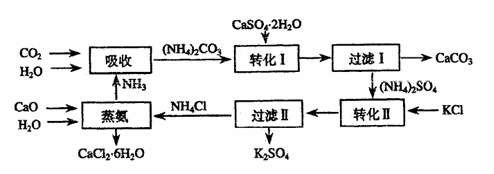
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3)过滤I操作所得固体中,除CaCO3外还含有 (填化学式)等物质,
该固体可用作生产水泥的原料。
(4)过滤I操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:
。
(5)硫酸钙结晶水合物(CaSO4·6H2O)是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(6)上述工艺流程中体现绿色化学理念的是 。
22.(12分)某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
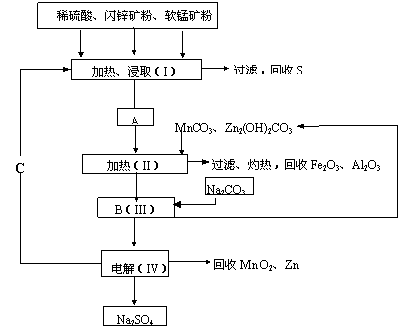 共同生产MnO2和Zn(干电池原料):
共同生产MnO2和Zn(干电池原料):
已知① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
|
 ② IV中的电解反应式为MnSO4+ZnSO4+2H2O
MnO2+
Zn+2H2SO4。
② IV中的电解反应式为MnSO4+ZnSO4+2H2O
MnO2+
Zn+2H2SO4。
(1)A中属于还原产物的是__________ ______。
(2)MnCO3、Zn2(OH)2CO3的作用是 ; C的化学式是___________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品除Na2SO4外,还有____ 。
(4)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
A.滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。
B.已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式: ;
C.判断该反应到达滴定终点的现象为 。
D.假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为_______mol/L。
21.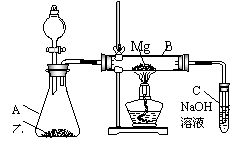 (11分) 已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性(提示:2Mg+CO2=2MgO+C)
(11分) 已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性(提示:2Mg+CO2=2MgO+C)
Ⅰ、用如图所示的装置进行Mg和SO2的实验:
⑴选择制取SO2的合适试剂 。
①10%的H2SO4溶液;②80%的H2SO4溶液;③Na2SO3固体; ④CaSO3固体
⑵写出装置B中发生的主要反应的化学方程式:
⑶你认为该装置是否有不足之处? ,如果有,请一一说明
Ⅱ、某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料后得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si; ②Mg在点燃的条件下即可与SiO2反应;
③金属硅化物与稀H2SO4反应生成硫酸盐和SiH4;
④Si和SiO2均不与稀H2SO4反应; ⑤SiH4在空气中自燃。
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀H2SO4溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀H2SO4溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
⑷该小组“实验室制Si”的化学方程式是
⑸你估计“用稀H2SO4溶解固体产物时,发现有爆鸣声和火花”的原因是
19.(10分)工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
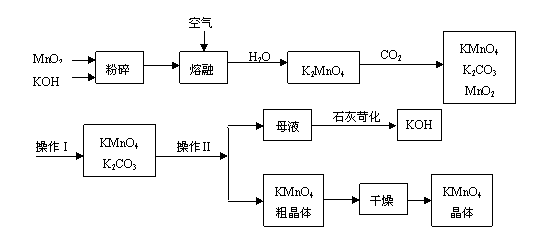

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有 、 (写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
20.(13分)硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•6H2O,商品名为摩尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
|
温度/℃ |
10 |
20 |
30 |
40 |
50 |
70 |
|
(NH4)2SO4 |
73.0 |
75.4 |
78.0 |
81.0 |
84.5 |
91.9 |
|
FeSO4·7H2O |
40.0 |
48.0 |
60.0 |
73.3 |
- |
- |
|
(NH4)2SO4•FeSO4•6H2O |
17.2 |
26.4 |
33.0 |
46.0 |
- |
- |
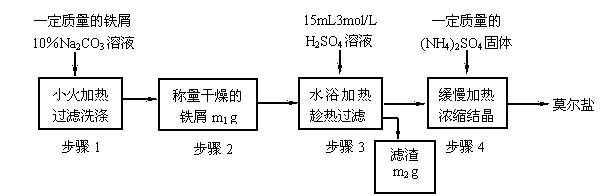 (一)实验室制取少量莫尔盐的流程如下:
(一)实验室制取少量莫尔盐的流程如下:
试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是 ;
(2)步骤3中进行“趁热快速过滤”,可采取的措施是 (写出1种),趁热过滤的目的是______________________________________;
(3)步骤4中加热浓缩至__________________时为止;
(4)步骤4中析出的晶体不含(NH4)2SO4、FeSO4的原因是__________________________,
理论上制得的莫尔盐的质量为________________。
18. 已知反应BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断中正确的是
A. BeCl2溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B. Na2BeO2溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C. Be(OH)2既能溶于盐酸又能溶于烧碱溶液
D. BeCl2水溶液的导电性强,因此BeCl2一定是离子化合物
第Ⅱ卷 (非选择题共87分)
17. X、Y、Z三种元素,若:X+与Y-两种离子具有相同的电子层结构;Z元素的核内质子数比Y元素核内质子数少9个,Y和Z两元素可形成42个电子的YZ3-离子。下列说法正确的是
A.离子半径X+>Y- B.原子序数X>Y>Z
C.X、Y、Z均属于短周期元素 D.X、Y、Z可形成XYZ、XYZ3、XYZ4等化合物。
16.下列说法中,正确的是
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大
B.AgCl悬浊液中存在平衡: AgCl(s)  Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
C.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl) > Ksp(AgI)
D.硬水含有较多Ca2+、Mg2+、HCO3―、SO42―,加热煮沸可以完全除去其中的Ca2+、Mg2+
15. 下列比较中,可能正确的是
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大
B.0.2 mol•L-l NH4Cl 和 0.l mol•L-l NaOH 溶液等体积混合后:
c(NH4+) > c (Cl―) > c (Na+) > c (OH-) >c (H+)
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:
c (Na+) +c(H+) = c (S2―) +c (HS―)+c (OH―)
D.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;
c(NH4+) 由大到小的顺序是:①>②>③>④
14.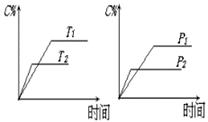 可逆反应a
A(s)+b
B(g)
可逆反应a
A(s)+b
B(g) c C(g)+d
D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如右图,下列叙述正确的是
c C(g)+d
D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如右图,下列叙述正确的是
A、达到平衡后,加入催化剂则C%增大
B、达到平衡后,若升高温度,平衡向左移动
C、化学方程式中b >c +d
D、达平衡后,增加A的量,有利于平衡向右移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com