
题目列表(包括答案和解析)
17、某醋酸溶液与0.01 mol·L-1 NaOH溶液等体积混合(忽略溶液体积变化),混合后溶液显碱性。下列有关叙述不可能出现的是
A.混合后溶液中:c(CH3COO-) + c(OH-) = c(Na+) + c(H+)
B.该醋酸溶液中:c(H+) = 0.01 mol·L-1
C.该醋酸溶液的物质的量浓度大于0.01 mol·L-1
D.混合溶液中:c(CH3COO-) > c(Na+)
16、下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由H+(aq)+ OH-(aq)= H2O(l) △H = -57.3 kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)= C(金刚石) △H = +1.90 kJ·mol-1可知,金刚石比石墨稳定
D.在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式为 2H2(g)+ O2(g)= 2H2O(l) △H = -285.8 kJ·mol-1
15、保持恒温、恒容,在某密闭容器中发生反应:2A(g)+2B(g)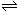 C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ--从正反应开始,A、B的起始物质的量均为2mol ;Ⅱ--从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ--从正反应开始,A、B的起始物质的量均为2mol ;Ⅱ--从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
A.Ⅰ、Ⅱ两种途径从反应开始到平衡状态所消耗的时间相同
B.Ⅰ、Ⅱ两种途径从反应开始到平衡状态的过程中,体系的总密度始终保持不变
C.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的物质的量分数相同
D.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的浓度相同
14、X、Y、Z为短周期元素,原子序数依次增大。X的最外层电子数是Y原子最外层电子数的2 倍,质子数比Y少5,X和Z在同一主族。下列叙述不正确的是
A.原子半径:Y>Z
B.X元素的一种单质可用于消毒杀菌
C.Y的氧化物是工业制取Y单质的主要原料
D.Z的单质在氧气中点燃可生成两种酸性氧化物
13、工业制硝酸的其中一步反应为氨的氧化,反应方程式为:
4NH3(g) +
5O2(g) 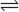 4NO(g) + 6H2O(g) △H=-1025 kJ/mol
4NO(g) + 6H2O(g) △H=-1025 kJ/mol
氧化过程中还伴随有N2O、N2等物质生成。有关该反应的说法正确的是
A.反应处于平衡状态时,c(NH3)·c(O2)=c(NO)·c(H2O)
B.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施
12、下列化学反应的离子方程式正确的是
A.碳酸钙溶解于醋酸:CaCO3 + 2H+ = Ca2+ + CO2 + H2O
B.Fe3O4溶解于稀硝酸中:Fe3O4 + 8H+ = 3Fe3+ + 4H2O
C.用烧碱溶液吸收氯气:Cl2 + 2OH- = Cl- + ClO- + H2O
D.石灰乳与MgCl2溶液反应:Mg2+ + Ca(OH)2 = Ca2+ + Mg(OH)2
11、下列关于铜电极的叙述正确的是
A.铜锌原电池中铜电极上发生氧化反应
B.电解饱和食盐水制烧碱时,用铜作阳极
C.电解法精炼铜时,粗铜连接电源的正极
D.电镀铜和精炼铜时,均用纯铜作阴极
10、设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.常温常压下,1 mol氦气含有的核外电子数为4 nA
B.一定条件下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3 nA
C.标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为nA
D.标准状况下,nA个NO分子和0.5nA个O2分子混合后气体的总体积为33.6 L
9、某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
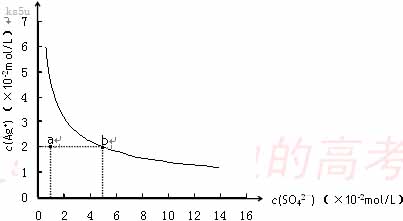
A.含有大量SO42-的溶液中肯定不存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
8、用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应
Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12mol 电子转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com