
题目列表(包括答案和解析)
19.(14分)柠檬酸的结构简式为 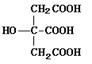 。若将柠檬酸加热到150摄氏度时,则分子内脱去一分子水形成不饱和酸--顺乌头酸,后者在一定条件下会和水反应又生成柠檬酸和异柠檬酸两种异构体。
。若将柠檬酸加热到150摄氏度时,则分子内脱去一分子水形成不饱和酸--顺乌头酸,后者在一定条件下会和水反应又生成柠檬酸和异柠檬酸两种异构体。
(1)写出下列物质的结构简式
顺乌头酸____________________________________;
异柠檬酸____________________________________。
(2)由柠檬酸转化为顺乌头酸的反应是 __________________反应(填反应类型),顺乌头酸形成柠檬酸和异柠檬酸的反应是_________________反应(填反应类型)。
(3)柠檬酸酯无毒无味,可以替代传统增塑剂,请写出由异柠檬酸合成异柠檬酸三乙酯(TEC)的化学反应式 __________________________________________________________________。
(4)1摩尔的柠檬酸可以和3摩尔的碳酸氢钠反应产生标准状况下的67.2L二氧化碳,1mo1X能与足量碳酸氢钠溶液反应放出44.8LCO2(标准状况),则X的分子式是:( )
A、C5H10O4 B.C4H8O4 C.C3H6O4 D.C2H2O4
18.(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,
欲除去食盐中的Ca2+、Mg2+、SO42-离子,滴加试剂顺序正确的是_________(符合条件的都选)。
A. Na2CO3 BaCl2 NaOH HCl
B. NaOH HCl BaCl2 Na2CO3
C. NaOH BaCl2 Na2CO3 HCl
D. BaCl2 Na2CO3 NaOH HCl
(2) 工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g~0.5g。已知NaNO2能发生如下反应(方程式已配平):
2NO2-+xI-+yH+=2NO↑+I2+zH2O,请回答
根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为___________。
(3)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用
 仪器除药匙、玻璃棒外还有__________________________(填仪器名称)。
仪器除药匙、玻璃棒外还有__________________________(填仪器名称)。
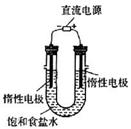
电解饱和食盐水的装置如图所示,若收集的H2为2 L, 则同样条件下收集的Cl2<2 L,原因是____________________________________
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
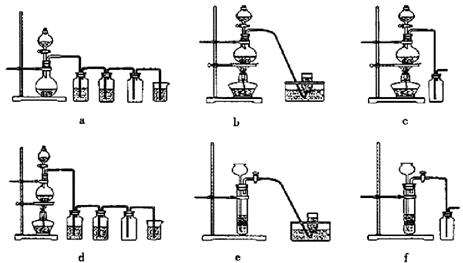
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
四,综合题(30分)
17。(14)下列框图中的A-G是中学化学中常见的七种物质,所有物质均由短周期元素组成,已知常温、常压下D为无色液体,基保C、E为气态单质,B为金属单质,A、G、F焰色反应都显黄色。A-G可发生如下转化:
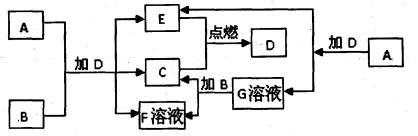 请填写下列空白
(1)D的结构式为 ,金属B原子结构示意图为 ,G的电子式为 。
(2)5.4gB与足量的G溶液完全反应,转移的电子的物质的量为 。
(3)向F的水溶液中通入足量的CO2气体,其离子方程式为 。
(4)8g单质C在E中完全燃烧生成气态D,放出967.2kJ的热量,该反应的热化学方程式为: 。
请填写下列空白
(1)D的结构式为 ,金属B原子结构示意图为 ,G的电子式为 。
(2)5.4gB与足量的G溶液完全反应,转移的电子的物质的量为 。
(3)向F的水溶液中通入足量的CO2气体,其离子方程式为 。
(4)8g单质C在E中完全燃烧生成气态D,放出967.2kJ的热量,该反应的热化学方程式为: 。
三,实验题(16分)
16.某有机物结构简式为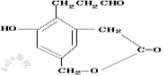 该有机物酸性条件下水解后的生成物分别与金属钠,氢氧化钠,新制氢氧化铜发生反应,从理论上计算出1mol生成物分别与上述三种无机物反应消耗的物质的量 的比为
( )
该有机物酸性条件下水解后的生成物分别与金属钠,氢氧化钠,新制氢氧化铜发生反应,从理论上计算出1mol生成物分别与上述三种无机物反应消耗的物质的量 的比为
( )
A.1:1:1 B .3:2:2 C .3:2:3 D.6:4:5
二,推断题(14分)
15.将多磷酸钠溶液通过氢型阳离子交换柱,进行Na+与H+的交换,得到多磷
酸,其结构为:
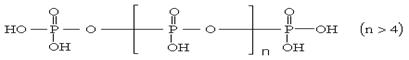
交换后的溶液用0.1mol·L-1的NaOH溶液滴定。在消耗NaOH溶液42.00mL和50.00mL时各有一个滴定终点。则下列判断正确的是
A.两端的__OH上的氢难电离 B.中间链上的__OH上的氢难电离
C.所有的__OH上的氢电离能力都一样 D.无法判断哪一部分__OH上的氢难易电离
14.下列表格中的各种情况,可以用下面的图象曲线表示的是
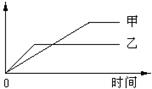
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
等质量钾、钠分别与足量水反应 |
H 2质量 |
钠 |
钾 |
|
B |
相同质量氨,在同一容器中 2NH3  N2+3H2 N2+3H2 |
氨气的转化率 |
500℃ |
400℃ |
|
C |
在体积可变的恒压容器中,体积比1:3的N2、H2,N2+3H2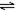 2NH3 2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2molSO2与lmolO2,在相同温度下2SO2+O2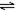 2SO3 2SO3 |
SO3物质的量 |
10个大气压 |
2个大气压 |
13.相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3 C.Al Cl3 D. Al2O3
12.下列实验能达到目的的是
A.用石灰水、小苏打、淀粉和食醋等进行碘盐中碘的检验实验
B.油脂皂化后可用盐析后过滤的方法使高级脂肪酸钠和甘油充分分离
C.用玻璃棒搅拌漏斗中的液体以加快过滤的速度
D.准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol·L-1的溶液
11.甲醇燃料电池中发生的化学反应为:如果在酸性溶液中甲醇与氧气作用生成水和二氧化碳,如果在碱性条件则生成碳酸根离子和水。下列说法正确的是 ( )
A.该电池酸性溶液中负极发生的反应是 CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e
B.该电池酸性溶液中负极发生的反应是 O2(g)+4H+(aq)+4e-=2H2O(1)
C.该电池碱性溶液中正极发生的反应是 CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.该电池碱性溶液中正极发生的反应是 O2(g)+2H2O(1)+4e-=4OH-
9.常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )
①硫酸氢钠溶液 ②醋酸铵水溶液 ③苯酚钠水溶液 ④硫酸铜通入足量硫化氢后的水溶液
A.①④ B.①② C.②③ D.③④
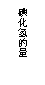
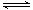 2HI(g),在温度T1和T2时,产物的量和时间的关系如下图所示,符合图象的正确的判断是( )
2HI(g),在温度T1和T2时,产物的量和时间的关系如下图所示,符合图象的正确的判断是( )
A.T1>T2,△H>0 B.T1>T2,△H<0
C.T1<T2,△H>0 D.T1<T2,△H<0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com