
题目列表(包括答案和解析)
15.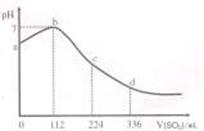 标准状况下,某同学向
100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是
标准状况下,某同学向
100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是
A.ab 段的反应是:SO2 + 2H2S=3S↓+2 H2O
B.b 点对应的溶液导电性最强
C.原H2S溶液的物质的量浓度为0.1mol·L-1
D.bd段对应的溶液呈酸性的原因是:H2SO3 = 2H+ + SO32-
14.下列用来表示物质变化的反应式中,错误的是
A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH-
B.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:
SO42- + H+ + Ba2+ + OH- = BaSO4↓+ H2O
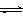 C.明矾水解的离子方程式:Al3+ + 3H2O Al(OH)3 + 3H+
C.明矾水解的离子方程式:Al3+ + 3H2O Al(OH)3 + 3H+
D.K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3 + 6HCl = K37Cl + 3Cl2↑+ 3H2O
13.下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石) ΔH>0,可知金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH- (aq)= H2O(l) ΔH = -57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l);ΔH = -285.8 kJ· mol-1
12.设NA表示阿伏加德罗常数的值。下列说法中正确的是
A.5.6 g Fe和一定量的浓HNO3或稀硝酸完全反应,转移电子均为0.3 NA
B.16 g氧气或臭氧的氧原子个数均为NA
C.标准状况下的4.48L的乙烯或己烷所含的分子数均为0.2NA
D.28.6 g Na2CO3·10H2O在晶体中或溶液中,含有的CO2- 3离子数均等于0.1 NA
11. 往含Br-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质 量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(Br-)/c(Cl-)的比值约为
往含Br-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质 量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(Br-)/c(Cl-)的比值约为
A.(V2-V1)/V1 B.V1/V2
C.V1/(V2-V1) D.V2/V1
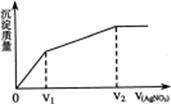
10.实验是化学研究的基础,关于下列各装置图的叙述中,正确的是

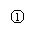
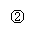
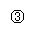
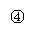
A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积的装置
9.在某稀溶液中含有0.2mol HNO3和x mol H2SO4,向其中加入19.2g 铜粉,充分反应后产生的气体在标准状况下的体积为4.48L,则x值至少为
A.0.6 B.0.4 C.0.3 D.0.2
8.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
7.被称为万能还原剂的NaBH4溶于水并和水发生反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是
A.当有标准状况下的22.4L的H2生成时转移的电子数是1mol
B.氧化剂与还原剂的物质的量之比为1∶2
C.硼元素被氧化,氢元素被还原
D.NaBO2是氧化产物,H2是还原产物
6.自来水加工处理流程如下,下列有关说法不正确的是
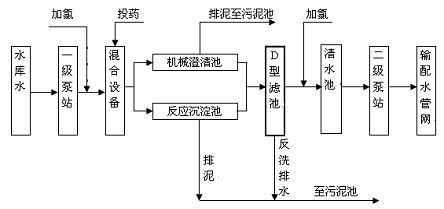
A.用ClO2消毒自来水,消毒效率比同质量氯气高
B.若用FeSO4作混凝剂,最终铁元素将以Fe(OH)2形式进入反应沉淀池
C.自来水生产中,前加氯起消毒杀菌作用,后加氯是保持水中有效氯的含量,防止自来水二次污染
D.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com