
题目列表(包括答案和解析)
5.解:
(1)设9.2 g固体中Fe的质量为x, 盐酸的质量分数为w。
Fe+ 2HCI = FeCl2+H2
56 73 2
x 50.0g×w 0.10 g
56:2=x:0.10g x=2.8g
73:2=50.0g×w :0.10g w=7.3% 答:略。
(2)设与CuS04反应的Fe的质量为y
Fe+CuS04=FeS04+Cu
56 64
y (9.2-2.8)g
56:64=y:(9.2-2.8)g y=5.6g
答:略。
(3)<
因为有少量Fe与CuS04溶液中的酸性物质发生了反应
4.设原混合物中含铜的质量为x,生成硫酸锌的质量为y
Zn + H2SO4 = ZnSO4 + H2↑
65 161 2
(16-x) y 0.4g
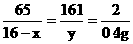
x=3g (1分) y=32.2g
反应后所得溶液中溶质的质量分数:

答:(1)混合物中含铜3g
(2)反应后所得溶液的溶质质量分数为10%。
3.解:Ti元素的质量分数为:[48/(48+2×16)]×100%=60%
2.解:设铁合金中含铁质量为x,反应生成FeSO4的质量为y
Fe + H2SO4 = FeSO4 + H2↑
56 152 2
x y 0.3g
56/x = 2/0.3g x = 8.4g
152/y = 2/0.3g y = 22.8g
(1)铁合金中C%=(8.5g-8.4g)/ 8.5g×100%≈1.18% (1%-1.2%都可以)
∵0.03%<1.18%<2% ∴ 该铁合金为钢
(2) FeSO4的质量分数 = 22.8g/(91.9g + 8.4g - 0.3g)×100%
= 22.8%
答:(略)
1.(1)80g (2)56% (3)33.5%
5. CaCO3 B. CaO C. CO2 D. Ca(OH)2 或A. H2O B. O2 C. H2 D. CuO 等等。
4.(1)Fe和Cu
(2)CuO+2HCI=CuCl2+H20或Fe203+6HCI=2FeCl3+3H20
(3)C+2Cu=2Cu+C02或2Fe203+3C=4Fe+3C02+ H2O H2 、CO
3. (1)H2 FeS04(或FeCl2) Cu
(2)3Fe+202=点燃=Fe304
2. Fe;Fe2O3;FeSO4;CO
1.⑴
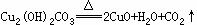
⑵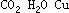
⑶  (其他合理答案也可)
(其他合理答案也可)
⑷ CD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com