
题目列表(包括答案和解析)
3、 化学方程式。
(1) 定义:用化学式来表示化学反应的式子
(2) 化学方程式的书写原则:
一是以客观事实为依据;二是要遵守质量守恒定律
(3) 书写化学方程式的方法和步骤。
(4) 化学方程式表示的意义
①表示反应物和生成物的种类 ②表示反应的条件
③表示反应物、生成物间原子、分子个数比
④表示反应物、生成物间的质量比
2、 质量守恒定律
(1) 定义:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个定律叫质量守恒定律。
(2) 质量守恒定律的解释
 原子种类没有变化
原子种类没有变化
反应前后 原子数目没有增减
 (3)化学反应前后一定不变的量: ①原子种类 ② 元素种类 ③ 原子数目
(3)化学反应前后一定不变的量: ①原子种类 ② 元素种类 ③ 原子数目
④物质总质量
1、 化合反应和分解反应
 (1)化合反应:A+B C
(1)化合反应:A+B C
 (2)分解反应:A B+C
(2)分解反应:A B+C
6、 灭火和火灾自救
 (1)
温度达到着火点以下
(1)
温度达到着火点以下
可燃物燃烧条件 跟氧气充分接触
(2)
 温度达到着火点以下
温度达到着火点以下
灭火方法 跟氧气隔绝
(3)火灾自救及措施(看课本)
5、 催化剂。
 一变:改变其他物质化学反应的速度
一变:改变其他物质化学反应的速度
 二不变: 本身质量
化学反应前后不变
二不变: 本身质量
化学反应前后不变
本身化学性质
4、 氧气的制取
(1) 实验室制取
① 实验室常用分解过氧化氢或加热高锰酸钾或加热氯酸钾和二氧化锰混合的方法来制取,反应的化学方程式分别为:
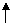 2H 2O2 ====2H2O +O2
2H 2O2 ====2H2O +O2
 2KMnO4====K2MnO4 + MnO2 +O2
2KMnO4====K2MnO4 + MnO2 +O2
 2KClO3 =======2KCl +3O2
2KClO3 =======2KCl +3O2
② 实验室装置图课本45和46页
③ 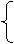 排水法(因为氧气不易溶于水或难溶于水)
排水法(因为氧气不易溶于水或难溶于水)
收集方法 向上排空气法(因为氧气密度比空气大)
(2) 工业制法:分离空气发(属于物理变化的过程)
3、 氧化反应:物质与氧发生的化学反应。
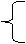 燃烧:发光发热的剧烈的氧化反应,可引起爆炸
燃烧:发光发热的剧烈的氧化反应,可引起爆炸
缓慢氧化:速率缓慢的氧化反应,可引起自燃
2、 氧气的化学性质:供呼吸、支持燃烧、化学性质较活泼、具有氧化性。
(1) 硫在氧气中燃烧:
(2)S + O2 ===SO2 在氧气中燃烧时发出明亮的蓝紫色火焰,放出大量的热,生成一种有刺激性气味的气体。(在空气中燃烧时发出淡蓝色的火焰)
(2) 铁在氧气中燃烧:
(3)3Fe+2O2 ==== Fe 3O4 燃烧时火星四射,放出大量的热,生成一种黑 色固体(注意:铁丝燃烧时要绑一根火柴来引燃,瓶底要放点水或细砂防止炸裂瓶底)
1、 氧气的物理性质:
通常情况下是一种无色、无味气体
 密度比空气大
密度比空气大
不易溶于水(或难溶于水)
三态变化,液态氧、固态氧呈淡蓝色。
3、 空气的利用。
(1) 氮是构成生命体蛋白质的主要元素。
 灯泡、食品中作保护气
灯泡、食品中作保护气
氮气的用途 制化肥、炸药、染料等
液态氮可作冷冻剂
(2) 氧气与人类的关系最密切。
氧气的用途:
 提供呼吸、急救病人、登山、潜水等
提供呼吸、急救病人、登山、潜水等
支持燃烧、气焊、气割、炼钢等
(3) 稀有气体:化学性质很稳定,通电时能发出各种有色光。
 制作保护气
制作保护气
用途 制成各种电光源
用于激光技术
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com