
题目列表(包括答案和解析)
1、下列各组物质中必定属于同系物的是
A. 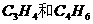 B.
B.
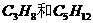
C、CH2=CH2和CH2=CH-CH=CH2 D. 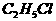 和
和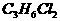
20.(10分)某学生探究过氧化钠与水反应时,取一定量的过氧化钠固体置于试管中,加水使其充分反应至不再产生气体为止,将所得溶液分为两份分别置于甲.乙两试管,再进行下列实验。
实验一:向甲试管中滴入几滴酚酞试液,溶液先变红后褪色;
实验二:向乙试管加入少许MnO2并微热有大量气体产生,待无气体产生后,滴入几滴酚酞试液,溶液变红,但持久不褪色;再向该溶液中滴入2mol/L H2SO4溶液酸化,溶液红色褪去,且产生少量气体。
资料卡片:Na2O2可看作二元弱酸H2O2对应的盐。
请回答下列问题:
(1)过氧化钠第一步水解的离子方程式为 。
(2)实验一中使溶液红色褪去的物质是________________。
(3)实验二中H2SO4酸化后反应的化学方程式_ _________ _._______________ 。
(4)从反应原理角度看,过氧化钠与水反应的氧化产物是氧气,还原产物应是____。
A.H2O2 B.H2O C.NaOH D.NaHO2
21(13分)Fe.Cu都是人类最早使用的金属。某校化学研究性学习小组的同学运用实验手段研究Fe.Cu的相关性质,请你参与研究并完成下列各题:
(1)甲同学取一束细铜丝用砂纸打磨后放在酒精灯上加热至红热,然后迅速伸入盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是 。
(2)乙同学为探究Fe在冷浓HNO3和热浓HNO3中的反应情况,设计了如图所示的实验装置:
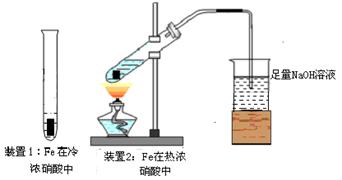
乙同学发现装置1中Fe未溶解,其原因是 ;装置2生成的气体(假定为NO2和NO混合气体)全部通入100mL 4mol/L NaOH溶液,恰好被完全吸收,反应为:
NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
若生成NaNO3和NaNO2物质的量之比为1:3,则混合气体中NO2和NO的体积比为 。
(3)丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,反应一
段时间后不再溶解。
①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应。他依据的反应现象是 。
②丁同学认为丙同学的结论不完全正确,他的理由是 。
(4)请你设计实验证明某溶液中只含Fe2+而不含Fe3+。说明具体实验操作和实验现象:
。
18(10分)已知A,B,C均为常见的单质,其中A为金属单质,B.C为非金属单质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)。
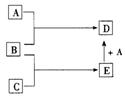
请回答下列问题:
(1)若常温下B.C均为气体,D是磁性晶体,则E的电子式为___ _____,A和E在一定条件下反应生成D的化学方程式为_________ ______。
(2)若常温下B为气体,C为黑色固体,则A的原子结构示意图为 ,
E的结构式为___ _____,A和E在一定条件下反应生成D的化学方程式为______________________ __。
19(8分)短周期元素A.B.C.D原子序数依次增大,A.B两元素形成BA3气体,其水溶液呈碱性;A.C同主族,B.C.D三元素的最高价氧化物的水化物两两之间可以相互反应生成盐和水。请回答下列问题:
(1)BA3分子的空间构型为______ 。
(2)D的单质在海水中构成的原电池,可作为海洋灯塔的能源。试写出该电化学反应的电极反应式:负极反应 ,正极反应 。
(3)写出C.D两元素最高价氧化物的水化物反应的离子方程式 。
16(8分)室温下,向一定量1mol/L氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量。请分析上述实验过程,回答下列问题:
(1)实验过程中水的电离程度变化趋势是先 后__ _(填“变大”.“变小”或“不变”)。
(2)实验过程中,当溶液pH恰好等于7时,此时溶液中主要溶质的化学式是__ _ _._ __,溶液中离子浓度的大小顺序是_________ ___ ______ 。
17(6分)人们对酸碱的认识,经历了一个由浅入深.由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,提出了酸碱溶剂理论。该理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。已知:H2O+H2O H3O++OH-,则液氨自身电离的方程式为
。
H3O++OH-,则液氨自身电离的方程式为
。
(2)1923年丹麦化学家布朗斯特(Brφusted)和英国化学家劳莱(Lowry)提出了酸碱质子理论。该理论认为:凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论,下列粒子在水溶液既可看作酸又可看作碱的是 。
A.H2O B.NH4+ C.CH3COO- D.Cl- E.HCO3-
(3)1923年路易斯(Lewis)提出酸碱电子理论。该理论认为:凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+ [∶OH
]-  H∶OH
H∶OH
则反应Al3++3H2O Al(OH)3+3H+中的酸是 (填Al3+或H2O)。
Al(OH)3+3H+中的酸是 (填Al3+或H2O)。
15.已知反应:2SO2(g)+O2(g) 2SO3(g)
△H<0。某温度下,将2 mol SO2和1
mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g)
△H<0。某温度下,将2 mol SO2和1
mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
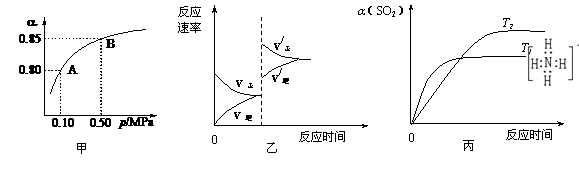

A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2.O2.SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
第Ⅱ卷(非选择题,共55分)
14.将足量的甲和乙组成的混合气体通入丙溶液,一定能产生沉淀的是
|
|
甲 |
乙 |
丙 |
|
A. |
NO2 |
SO2 |
BaCl2 |
|
B. |
HCl |
CO2 |
石灰水 |
|
C. |
CO2 |
SO2 |
石灰水 |
|
D. |
CO2 |
NH3 |
CaCl2 |
13.乙酸橙花酯是一种食用香料,结构如图所示。关于该物质的说法有:
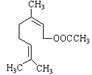
①该化合物属于酯类;②分子式C11H18O2;③1 mol该化合物最多可与2 mol H2反应;
④该化合物能发生的反应类型有:加成.取代.氧化.聚合;⑤该化合物的同分异构体可能含有苯环。其中正确的是
A.②③⑤ B.①③④ C.①④⑤ D.①③⑤
12. 已知A+.B2+.C-.D2-为同周期主族元素的离子,则下列叙述正确的是
A.离子半径:D>C>B>A
B.原子序数:D>C>B>A
C.原子半径:A>B>C>D
D.最高价氧化物的水化物碱性:A>B,酸性:C>D
11.下列电离方程式或离子方程式书写正确的是
A.小苏打溶于水:NaHCO3 = Na++H++CO32-
B.稀硫酸和Ba(OH)2溶液混合:Ba2++OH-+H++SO42- = BaSO4↓+H2O
C.将SO2通入氯水:Cl2+SO2+2H2O = 4H++2Cl-+SO42-
D.澄清石灰水中加入盐酸:Ca(OH)2+2H+=Ca2++2H2O
10.下列各组物质中,所含元素的质量分数相同,但既不属于同分异构体,也不属于同系物的是
A.乙烯.丙烯 B.甲醇.乙二醇
C.乙炔.苯 D.丙烯.环丙烷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com