
题目列表(包括答案和解析)
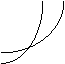
16、同时符合下列两个图像的反应是(温度T1>T2) ( )
 v
v

 v逆 v正
v逆 v正

T1

 T2
T2

 压强
时间
压强
时间
0 0
A、N2O3(g) NO2+NO;△H>0
NO2+NO;△H>0
B、CO2+C(s) 2CO;△H>0
2CO;△H>0
C、3NO2+H2O(l) 2HNO3(l)+NO;△H<0
2HNO3(l)+NO;△H<0
D、4NH3+5O2 4NO+6H2O(l);△H<0
4NO+6H2O(l);△H<0
第Ⅱ卷(非选择题 共86分)
15.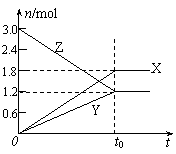 在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是

 A.该反应的化学方程式为:3X+2Y 2Z
A.该反应的化学方程式为:3X+2Y 2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
14.t℃时,将溶质质量分数为a %的NaOH溶液蒸发掉m g水后恢复至原温度,恰好得到质量分数为2a %的NaOH饱和溶液V mL,则下列说法中正确的是
A.t℃时NaOH的溶解度为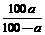 g
g
B.原溶液的质量为2m g
C.可以求算原溶液的物质的量浓度
D.保持t℃,向原溶液中加入2a gNaOH可达饱和
13. 右图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g·mol-1,则理论上氯化铯晶体的密度为
右图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g·mol-1,则理论上氯化铯晶体的密度为
A. g·cm-3
B.
g·cm-3
B.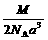 g·cm-3
g·cm-3
C.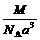 g·cm-3
D.
g·cm-3
D.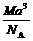 g·cm-3
g·cm-3
12、下列化学事实与分子间形成氢键无关的是
A.氢键的存在使卤化氢中HF的沸点“反常”
B.H2O分子的化学性质非常稳定,不易分解
C.氨气易液化,且极易溶于水
D.冰晶体的结构疏松,密度比液态水小
11.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)……下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
|
元素 |
I1/eV |
I2/eV |
I3/eV |
|
甲 |
5.7 |
47.4 |
71.8 |
|
乙 |
7.7 |
15.1 |
80.3 |
|
丙 |
13.0 |
23.9 |
40.0 |
|
丁 |
15.7 |
27.6 |
40.7 |
下列说法正确的是
A.甲的金属性比乙强 B.乙的化合价为+1价
C.丙可能为非金属元素 D.丁一定是金属元素
10、下列事实中,能应用勒夏特列原理来解释的是
A.往二氧化碳的水溶液中加碱有利于CO32-的生成
B.加入催化剂有利于SO2和O2反应制SO3
C.500℃左右比室温更有利于合成氨的反应
D.硫酸生产中用98.3%的硫酸吸收SO3,而不用H2O
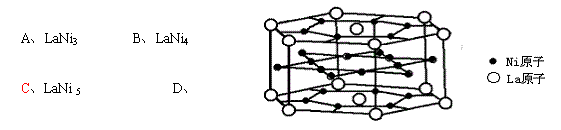
9、氢是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式:
8.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,8.8g CO2和N2O混合物中所含有的原子数为0.6 NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6 NA
C.标准状况下,3.36L丁烷中含有的非极性键数为0.6NA
D.在1L0.2mol/L的硫酸铁溶液中含有的硫酸根离子数为0.6 NA
7、下列反应的离子方程式不正确的是
A.溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2C12==2Fe3++Br2+4C1-
B.草酸和少量烧碱溶液:H2C2O4+OH-==HC2O4-+H2O
C.漂白粉溶液吸收过量的二氧化碳:ClO-十H2O+CO2==HClO+HCO3-
D.金属铝溶于氢氧化钠溶液 Al+2OH- = AlO2-+ H2 ↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com