
题目列表(包括答案和解析)
3.

 某不含结晶水的固体物质A在60℃时溶解度为60克,20℃时为20克,使含水n毫升的A饱和溶液从60℃冷却到20℃,经过充分结晶后进行过滤,滤液质量为150克(设水的密度为1克/毫升),试求n的值。 (n=125)
某不含结晶水的固体物质A在60℃时溶解度为60克,20℃时为20克,使含水n毫升的A饱和溶液从60℃冷却到20℃,经过充分结晶后进行过滤,滤液质量为150克(设水的密度为1克/毫升),试求n的值。 (n=125)


 [深化提高]
[深化提高]


 4.苦卤中含有的成分主要是氯化镁和氯化钠,图1-40是它们的溶解度曲线,请你应用本次实验中学到的方法和操作技能,设计一个实验,分别制备氯化镁晶体和氯化钠晶体。
4.苦卤中含有的成分主要是氯化镁和氯化钠,图1-40是它们的溶解度曲线,请你应用本次实验中学到的方法和操作技能,设计一个实验,分别制备氯化镁晶体和氯化钠晶体。






 [答] 经分析氯化镁和氯化钠溶解度特点,因氯化镁的溶解度受温度影响较大,而氯化钠的溶解度受温度影响较小,因此冷却热饱和溶液可析出氯化镁晶体,蒸发饱和溶液(蒸发溶剂)法可析出氯化钠晶体。实验设计如下:
[答] 经分析氯化镁和氯化钠溶解度特点,因氯化镁的溶解度受温度影响较大,而氯化钠的溶解度受温度影响较小,因此冷却热饱和溶液可析出氯化镁晶体,蒸发饱和溶液(蒸发溶剂)法可析出氯化钠晶体。实验设计如下:


 第一步:将苦卤溶于水,加热至沸腾,配成热饱和溶液;
第一步:将苦卤溶于水,加热至沸腾,配成热饱和溶液;


 第二步:冷却热饱和溶液至常温,析出大量晶体,主要是氯化镁晶体,可能含有少量氯化钠,过滤,得到晶体和滤液;
第二步:冷却热饱和溶液至常温,析出大量晶体,主要是氯化镁晶体,可能含有少量氯化钠,过滤,得到晶体和滤液;


 第三步:将滤液蒸发至有大量晶体析出,停止加热(不要蒸干),过滤得到晶体,主要成分是氯化钠,可能含有少量的氯化镁;
第三步:将滤液蒸发至有大量晶体析出,停止加热(不要蒸干),过滤得到晶体,主要成分是氯化钠,可能含有少量的氯化镁;


 第四步:将第二步制得的晶体再配制成热饱和溶液,再冷却、结晶、过滤,可得到较纯净的氯化镁晶体;
第四步:将第二步制得的晶体再配制成热饱和溶液,再冷却、结晶、过滤,可得到较纯净的氯化镁晶体;


 第五步:将第三步得到的晶体再配成常温下的饱和溶液,再蒸发(不要蒸干)、结晶、过滤,可得到较纯净的氯化钠晶体。
第五步:将第三步得到的晶体再配成常温下的饱和溶液,再蒸发(不要蒸干)、结晶、过滤,可得到较纯净的氯化钠晶体。


 第20课时
第20课时
1.

 练习用结晶方法制备晶体。
练习用结晶方法制备晶体。


 2.掌握搅拌、溶解、蒸发、结晶等基本实验操作技能。
2.掌握搅拌、溶解、蒸发、结晶等基本实验操作技能。


 3.了解结晶。
3.了解结晶。


 课堂学习设计
课堂学习设计


 [课前练习]
[课前练习]


 1.结晶是 固体溶质 从 饱和溶液 中析出的过程。
1.结晶是 固体溶质 从 饱和溶液 中析出的过程。


 2.结晶的方法通常有两种:(1)是 蒸发溶剂 法;(2)是 冷却热饱和溶液 法。前者一般用来得到 溶解度随温度变化较小 的固体溶质,如得到 氯化钠晶体 ,实例 海水晒盐 。后者一般用来得到 溶解度随温度变化较大 的固体溶质,如得到 硝酸钾晶体
。
2.结晶的方法通常有两种:(1)是 蒸发溶剂 法;(2)是 冷却热饱和溶液 法。前者一般用来得到 溶解度随温度变化较小 的固体溶质,如得到 氯化钠晶体 ,实例 海水晒盐 。后者一般用来得到 溶解度随温度变化较大 的固体溶质,如得到 硝酸钾晶体
。


 [科学探究]
[科学探究]


 一、制备硫酸铜晶体的原理
一、制备硫酸铜晶体的原理


 1.硫酸铜的溶解度是随温度升高而逐渐增大的,冷却硫酸铜的热饱和溶液可制得硫酸铜晶体。
1.硫酸铜的溶解度是随温度升高而逐渐增大的,冷却硫酸铜的热饱和溶液可制得硫酸铜晶体。


 2.冷却硫酸铜的热饱和溶液,会打破原来的溶解平衡,过剩的溶质就以晶体形式析出。晶体的析出生长必须要有一个核心(即晶核、晶种),这样才能使粒子一层一层地有规则地建筑起来。反复进行结晶,可以使晶体越长越大,成为大晶体。析晶时,如果开始晶种很少,过剩的溶质都能集中在少数的晶种上,获得的晶体就越大。振动会妨碍粒子的有序排列,使晶形不完整。晶形还与降温快慢有关。
2.冷却硫酸铜的热饱和溶液,会打破原来的溶解平衡,过剩的溶质就以晶体形式析出。晶体的析出生长必须要有一个核心(即晶核、晶种),这样才能使粒子一层一层地有规则地建筑起来。反复进行结晶,可以使晶体越长越大,成为大晶体。析晶时,如果开始晶种很少,过剩的溶质都能集中在少数的晶种上,获得的晶体就越大。振动会妨碍粒子的有序排列,使晶形不完整。晶形还与降温快慢有关。


 3.制备较大颗粒的晶体需控制的条件:晶种少,晶形完整,防震防尘,降温要缓慢。
3.制备较大颗粒的晶体需控制的条件:晶种少,晶形完整,防震防尘,降温要缓慢。


 二、硫酸铜晶体的生长
二、硫酸铜晶体的生长


 1.制备小晶体。
1.制备小晶体。


 烧杯中加入50毫升蒸馏水,在另一只较大的烧杯中加入100毫升左右的蒸馏水,小烧杯放在大烧杯中,使大烧杯内液面略高于小烧杯内液面。将大烧杯放在石棉网上加热,到比室温高出70℃时停止加热,向小烧杯内加入研细的硫酸铜晶体粉末,搅拌,配成饱和溶液。趁热过滤,得到澄清的硫酸铜溶液。在装有澄清硫酸铜溶液的烧杯上盖上干净的白纸,烧杯外壁围上棉花保温(或放在泡沫塑料盒中),静置一夜,便可制得晶形完整的小晶体。
烧杯中加入50毫升蒸馏水,在另一只较大的烧杯中加入100毫升左右的蒸馏水,小烧杯放在大烧杯中,使大烧杯内液面略高于小烧杯内液面。将大烧杯放在石棉网上加热,到比室温高出70℃时停止加热,向小烧杯内加入研细的硫酸铜晶体粉末,搅拌,配成饱和溶液。趁热过滤,得到澄清的硫酸铜溶液。在装有澄清硫酸铜溶液的烧杯上盖上干净的白纸,烧杯外壁围上棉花保温(或放在泡沫塑料盒中),静置一夜,便可制得晶形完整的小晶体。


 2.小晶体“长大”为大晶体。
2.小晶体“长大”为大晶体。


 晶形完整的小晶体用线系住,放人温度略高于常温的硫酸铜澄清饱和溶液中,保温,缓慢冷却,小晶体慢慢长大。反复操作,小晶体便“成长”为大晶体。
晶形完整的小晶体用线系住,放人温度略高于常温的硫酸铜澄清饱和溶液中,保温,缓慢冷却,小晶体慢慢长大。反复操作,小晶体便“成长”为大晶体。


 三、实验成功的关键
三、实验成功的关键


 制备较大颗粒的晶体需要反复进行操作,获得形状完整的晶体的关键是控制实验条件。操作中应注意以下几点:
制备较大颗粒的晶体需要反复进行操作,获得形状完整的晶体的关键是控制实验条件。操作中应注意以下几点:


 (1)制备饱和溶液时,防止过饱和而析出晶体;
(1)制备饱和溶液时,防止过饱和而析出晶体;


 (2)过滤速度要快,防止饱和溶液迅速冷却析出晶体;
(2)过滤速度要快,防止饱和溶液迅速冷却析出晶体;


 (3)冷却速度要缓慢,用棉花或塑料泡沫保温,让饱和溶液缓慢冷却;
(3)冷却速度要缓慢,用棉花或塑料泡沫保温,让饱和溶液缓慢冷却;


 (4)晶种的选择是关键,要获得形状完整的晶种,应使用纯净的硫酸铜,防止灰尘落入溶液;饱和溶液要静置,避免振动;
(4)晶种的选择是关键,要获得形状完整的晶种,应使用纯净的硫酸铜,防止灰尘落入溶液;饱和溶液要静置,避免振动;


 (5)晶体的“成长”需要进行多次结晶,整个过程中在线上只留一粒晶体,多余的晶体要去掉,每次取出后要修改其外形,使其保持完整的(三斜晶系)形状。
(5)晶体的“成长”需要进行多次结晶,整个过程中在线上只留一粒晶体,多余的晶体要去掉,每次取出后要修改其外形,使其保持完整的(三斜晶系)形状。





 重点:1.搅拌、溶解、蒸发、结晶等基本实验操作技能。
重点:1.搅拌、溶解、蒸发、结晶等基本实验操作技能。


 2.了解用结晶的方法制备晶体。
2.了解用结晶的方法制备晶体。


 难点:掌握规范的实验操作的技能。
难点:掌握规范的实验操作的技能。


 课外同步训练
课外同步训练


 [基础过关]
[基础过关]


 1.下列关于饱和溶液的叙述,正确的是 ( B
)
1.下列关于饱和溶液的叙述,正确的是 ( B
)


 A.饱和溶液一定是浓溶液
A.饱和溶液一定是浓溶液


 B.在一定温度下,同一物质的饱和溶液一定比不饱和溶液的浓度大
B.在一定温度下,同一物质的饱和溶液一定比不饱和溶液的浓度大


 C. 任何物质的饱和溶液,当温度降低时一定会析出溶质
C. 任何物质的饱和溶液,当温度降低时一定会析出溶质


 D.饱和溶液析出晶体后,剩下溶液的浓度一定变小
D.饱和溶液析出晶体后,剩下溶液的浓度一定变小


 2.某温度下,将A物质的水溶液分成等量的两份,在第一份中加入9克A物质,充分搅
2.某温度下,将A物质的水溶液分成等量的两份,在第一份中加入9克A物质,充分搅


 拌,尚有1克固体不能溶解;将第二份溶液蒸发掉40克水,并恢复到原温度,溶液恰好饱和,则A物质在该温度下的溶解度是 ( B
)
拌,尚有1克固体不能溶解;将第二份溶液蒸发掉40克水,并恢复到原温度,溶液恰好饱和,则A物质在该温度下的溶解度是 ( B
)


 A.40克 B.20克 C.8克 D.无法确定
A.40克 B.20克 C.8克 D.无法确定
4.

 晶体和非晶体的重要区别是 ( C
)
晶体和非晶体的重要区别是 ( C
)


 A.熔化时是否需要吸收热量
B.熔化时是否有温度
A.熔化时是否需要吸收热量
B.熔化时是否有温度


 C熔化时的温度是否保持不变 D.熔化时是吸收热还是放出热
C熔化时的温度是否保持不变 D.熔化时是吸收热还是放出热


 [科学探究]
[科学探究]


 一、天然水是溶液
一、天然水是溶液


 1.雨水、江水、河水、湖水、井水、海水、矿泉水等天然水,由于其中都溶有某些物质,所以都属于溶液。溶在其中的物质是 溶质
, 水是溶剂。
1.雨水、江水、河水、湖水、井水、海水、矿泉水等天然水,由于其中都溶有某些物质,所以都属于溶液。溶在其中的物质是 溶质
, 水是溶剂。


 2.矿泉水等天然水中含有很多微量成分,大部分对人体有一定的好处。
2.矿泉水等天然水中含有很多微量成分,大部分对人体有一定的好处。


 [设问] 我们如何将天然水,如海水中的溶质盐提取出来?
[设问] 我们如何将天然水,如海水中的溶质盐提取出来?


 二、晶体的形成
二、晶体的形成


 1.观察硫酸、铜、云母、食盐等晶体的外形。(颗粒小的可用显微镜观看)
1.观察硫酸、铜、云母、食盐等晶体的外形。(颗粒小的可用显微镜观看)


 结论:每种晶体都有一定的 几何形状 。
结论:每种晶体都有一定的 几何形状 。


 观察硫磺粉、红磷等非晶体的外形。
观察硫磺粉、红磷等非晶体的外形。


 结论:非晶体没有规则的 几何形状 。
结论:非晶体没有规则的 几何形状 。


 [讨论l 晶体和非晶体的区别有哪些?
[讨论l 晶体和非晶体的区别有哪些?


 [答] 晶体和非晶体的主要区别有两个:(1)晶体有固定的熔化温度,非晶体没有固定的
[答] 晶体和非晶体的主要区别有两个:(1)晶体有固定的熔化温度,非晶体没有固定的


 熔化温度;(2)晶体有规则的几何外形,非晶体则没有规则的几何外形。
熔化温度;(2)晶体有规则的几何外形,非晶体则没有规则的几何外形。


 2.晶体的形成。
2.晶体的形成。


 (1)蒸发溶剂的方法。
(1)蒸发溶剂的方法。


 当饱和溶液蒸发溶剂后(设温度保持不变),便会余下晶体,如我们吃的食盐就是通过海水晒盐得到的。
当饱和溶液蒸发溶剂后(设温度保持不变),便会余下晶体,如我们吃的食盐就是通过海水晒盐得到的。


 具体方法是:海水
具体方法是:海水 食盐晶体。
食盐晶体。


 蒸发溶剂得到晶体这种方法一般用在得到溶解度 受温度影响不大 的固体物质,如得到食盐。
蒸发溶剂得到晶体这种方法一般用在得到溶解度 受温度影响不大 的固体物质,如得到食盐。


 (2)冷却热饱和溶液的方法。
(2)冷却热饱和溶液的方法。


 [实验] 先配制一杯70℃的硫酸铜饱和溶液,然后用滴管吸取一滴硫酸铜饱和溶液,滴在有凹穴的玻璃片上,可以观察到有
硫酸铜晶体析出 。
[实验] 先配制一杯70℃的硫酸铜饱和溶液,然后用滴管吸取一滴硫酸铜饱和溶液,滴在有凹穴的玻璃片上,可以观察到有
硫酸铜晶体析出 。


 说明冷却热饱和溶液的方法也可以得到晶体,这种方法一般可以用来得到溶解度 受温度影响较大 的固体物质。如得到硫酸铜、 硝酸钾 等物质。
说明冷却热饱和溶液的方法也可以得到晶体,这种方法一般可以用来得到溶解度 受温度影响较大 的固体物质。如得到硫酸铜、 硝酸钾 等物质。


 (3)事实上以上几种方法都是综合起来使用,即先通过加热使溶液浓缩,再将溶液冷却,使溶液中的物质结晶析出。
(3)事实上以上几种方法都是综合起来使用,即先通过加热使溶液浓缩,再将溶液冷却,使溶液中的物质结晶析出。


 [思考] 为什么冷却热饱和溶液的方法可以得到晶体?
[思考] 为什么冷却热饱和溶液的方法可以得到晶体?


 [答] 由于在较高温度下先制成饱和溶液,当降低温度而冷却时,该物质溶解度减小,在一定量的溶剂里所能溶解的溶质减少,原来溶在里面的溶质就能以晶体形式结晶析出。
[答] 由于在较高温度下先制成饱和溶液,当降低温度而冷却时,该物质溶解度减小,在一定量的溶剂里所能溶解的溶质减少,原来溶在里面的溶质就能以晶体形式结晶析出。


 [典型例题解析]
[典型例题解析]


 [例1] 20℃时,食盐的溶解度为36克,现有20℃时饱和食盐溶液100克和200克,在温度保持不变的情况下,各蒸发掉10克水,析出晶体分别是多少?
[例1] 20℃时,食盐的溶解度为36克,现有20℃时饱和食盐溶液100克和200克,在温度保持不变的情况下,各蒸发掉10克水,析出晶体分别是多少?


 [解析] 由于原来都是饱和溶液,蒸发前后温度又保持不变,蒸发析出晶体后的剩余溶液仍是饱和溶液,题中蒸发的水的质量相等,因此只要考虑被蒸发掉的10克水中能溶解的溶质质量是多少即可。
[解析] 由于原来都是饱和溶液,蒸发前后温度又保持不变,蒸发析出晶体后的剩余溶液仍是饱和溶液,题中蒸发的水的质量相等,因此只要考虑被蒸发掉的10克水中能溶解的溶质质量是多少即可。


 设析出晶体的质量为x
设析出晶体的质量为x


 100克:36克=10克:x
100克:36克=10克:x


 x=3.6克
x=3.6克


 [答] 略
[答] 略


 [例2] t℃,将A物质的溶液恒温下蒸发掉20克水,析出晶体A 2克,第二次在恒温下再蒸发掉20克水,结果再析出8克晶体A,求t℃时A物质的溶解度。
[例2] t℃,将A物质的溶液恒温下蒸发掉20克水,析出晶体A 2克,第二次在恒温下再蒸发掉20克水,结果再析出8克晶体A,求t℃时A物质的溶解度。


 [解析] 此类题目中,由于前后几次温度都未发生改变,物质的溶解度应相同,而这里两次蒸发的水分一样,而析出的晶体量却不同,说明原溶液必定是不饱和溶液。第一次蒸发析出了晶体,说明溶液已变成了饱和,这样只要求第二次即可。(可以认为第一次蒸发的目的是为了第二次的蒸发服务)
[解析] 此类题目中,由于前后几次温度都未发生改变,物质的溶解度应相同,而这里两次蒸发的水分一样,而析出的晶体量却不同,说明原溶液必定是不饱和溶液。第一次蒸发析出了晶体,说明溶液已变成了饱和,这样只要求第二次即可。(可以认为第一次蒸发的目的是为了第二次的蒸发服务)


 设,℃时A物质的溶解度为x
设,℃时A物质的溶解度为x


 20克:8克=100克:x
20克:8克=100克:x


 x=40克
x=40克


 [答] 略
[答] 略


 [例3] 已知60℃和20℃时硝酸钾的溶解度分别为110克和31.6克,现有60℃时硝酸钾饱和溶液105克,将该饱和溶液冷却到20℃,可析出晶体多少?
[例3] 已知60℃和20℃时硝酸钾的溶解度分别为110克和31.6克,现有60℃时硝酸钾饱和溶液105克,将该饱和溶液冷却到20℃,可析出晶体多少?


 [解析] (1)此题可分为两步进行计算,先算出60℃时105克饱和溶液中含有多少溶质和溶剂,然后根据这些溶剂中在20℃时还能溶解硝酸钾多少,这样就能算出析出晶体的质量;
[解析] (1)此题可分为两步进行计算,先算出60℃时105克饱和溶液中含有多少溶质和溶剂,然后根据这些溶剂中在20℃时还能溶解硝酸钾多少,这样就能算出析出晶体的质量;


 (2)此题也可以根据以下公式进行计算:
(2)此题也可以根据以下公式进行计算:



 =
=





 (思考为什么可以用此公式进行计算)
(思考为什么可以用此公式进行计算)


 解法一:设105克60℃时硝酸钾饱和溶液中含有溶质质量为x
解法一:设105克60℃时硝酸钾饱和溶液中含有溶质质量为x


 210克:110克:105克:x
210克:110克:105克:x


 x=55克
x=55克


 则溶液中含溶剂质量为105克-55克:50克
则溶液中含溶剂质量为105克-55克:50克


 设20℃时50克水中能继续溶解硝酸钾的质量为y
设20℃时50克水中能继续溶解硝酸钾的质量为y


 100克:31.6克=50克:y
100克:31.6克=50克:y


 y=15.8克
y=15.8克


 所以析出晶体质量为55克-15.8克=39.2克解法二:设可析出晶体的质量为x
所以析出晶体质量为55克-15.8克=39.2克解法二:设可析出晶体的质量为x



 =
=


 x=39.2克
x=39.2克


 [答] 略
[答] 略


 [课内练习]
[课内练习]


 1.晶体与非晶体相比,有两个明显的特点:一是晶体有 固定的熔化温度 ;二是晶体有 规则的几何外形 。
1.晶体与非晶体相比,有两个明显的特点:一是晶体有 固定的熔化温度 ;二是晶体有 规则的几何外形 。


 2.从溶液中形成晶体的过程叫结晶,结晶的方法通常有两种:(1) 蒸发溶剂
;(2) 冷却热饱和溶液 。
2.从溶液中形成晶体的过程叫结晶,结晶的方法通常有两种:(1) 蒸发溶剂
;(2) 冷却热饱和溶液 。


 3.某物质的溶液250克,蒸发掉20克水,温度恢复到t℃,有5克晶体析出,若再蒸发掉20克水,将温度恢复到t℃,又析出10克晶体(晶体均不含结晶水)。则该物质在t~C时的溶解度是 ( B
)
3.某物质的溶液250克,蒸发掉20克水,温度恢复到t℃,有5克晶体析出,若再蒸发掉20克水,将温度恢复到t℃,又析出10克晶体(晶体均不含结晶水)。则该物质在t~C时的溶解度是 ( B
)


 A.25克 B.50克 C.15克 D.195克
A.25克 B.50克 C.15克 D.195克


 [课时小结]
[课时小结]


 重点:1.晶体与非晶体的区别。
重点:1.晶体与非晶体的区别。


 2.形成晶体的两种方法。
2.形成晶体的两种方法。


 3.有关结晶的简单计算。
3.有关结晶的简单计算。


 难点:有关结晶的计算。
难点:有关结晶的计算。


 课外同步训练
课外同步训练


 [基础过关]
[基础过关]


 1.在玻璃、松香、食盐和石蜡中,有一定的几何形状的是 食盐 ;有一定的熔点的是 食盐
,这种物质在熔化时的温度 保持不变 。
1.在玻璃、松香、食盐和石蜡中,有一定的几何形状的是 食盐 ;有一定的熔点的是 食盐
,这种物质在熔化时的温度 保持不变 。


 2.想从食盐溶液中得到食盐晶体,采取的方法应是 ( A
)
2.想从食盐溶液中得到食盐晶体,采取的方法应是 ( A
)


 A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法


 C.倒掉部分溶液的方法 D.升高温度的方法
C.倒掉部分溶液的方法 D.升高温度的方法


 3.将80℃时的硝酸钾饱和溶液降温到20℃,析出晶体后得到的溶液是 ( C
)
3.将80℃时的硝酸钾饱和溶液降温到20℃,析出晶体后得到的溶液是 ( C
)


 A.水 B.不饱和溶液 C.仍是饱和溶液 D.可能是饱和溶液
A.水 B.不饱和溶液 C.仍是饱和溶液 D.可能是饱和溶液


 4.用冷却热饱和溶液方法得到晶体的过程中(晶体不含结晶水),溶液中保持不变的是 ( B
)
4.用冷却热饱和溶液方法得到晶体的过程中(晶体不含结晶水),溶液中保持不变的是 ( B
)


 A.溶解度 B.溶剂质量 C.溶质质量 D.溶质的质量分数
A.溶解度 B.溶剂质量 C.溶质质量 D.溶质的质量分数


 [深化提高]
[深化提高]


 5.t℃时A物质的溶液,第一次恒温蒸发10克水,结果没有晶体析出,第二次恒温蒸发掉10克水,结果析出2克A,第三次再恒温蒸发10克水。下列有关晶体析出质量的判断中,正确的是 ( D
)
5.t℃时A物质的溶液,第一次恒温蒸发10克水,结果没有晶体析出,第二次恒温蒸发掉10克水,结果析出2克A,第三次再恒温蒸发10克水。下列有关晶体析出质量的判断中,正确的是 ( D
)


 A.一定大于2克 D.一定等于2克
A.一定大于2克 D.一定等于2克


 C. 一定小于2克 D.一定大于或等于2克
C. 一定小于2克 D.一定大于或等于2克


 6.已知100℃和10℃时硝酸钾的溶解度分别为246克和21克,现在有100℃硝酸钾饱和溶液346克,当温度降到10℃时,能析出硝酸钾晶体多少?
6.已知100℃和10℃时硝酸钾的溶解度分别为246克和21克,现在有100℃硝酸钾饱和溶液346克,当温度降到10℃时,能析出硝酸钾晶体多少?


 [解] 设可析出硝酸钾晶体的质量为x
[解] 设可析出硝酸钾晶体的质量为x



 =
=


 x=225克
x=225克





 第19课时
第19课时


 学生分组实验:硫酸铜晶体的生长
学生分组实验:硫酸铜晶体的生长


 学习目标
学习目标
3.

 学会有关物质结晶的简单计算。
学会有关物质结晶的简单计算。


 课堂学习设计
课堂学习设计


 [课前练习]
[课前练习]


 1.我们知道晶体是在 熔化 过程中有固定的
熔化温度 的固体;非晶体是在 熔化
1.我们知道晶体是在 熔化 过程中有固定的
熔化温度 的固体;非晶体是在 熔化


 过程中没有固定的 熔化温度
的固体。
过程中没有固定的 熔化温度
的固体。


 2.下列关于食盐熔化的说法中,正确的是 ( C
)
2.下列关于食盐熔化的说法中,正确的是 ( C
)


 A.只要对食盐加热,食盐就一定熔化
A.只要对食盐加热,食盐就一定熔化


 D.当温度达到食盐的熔点时,食盐就一定熔化
D.当温度达到食盐的熔点时,食盐就一定熔化


 C. 当食盐温度达到其熔点且继续加热时,食盐才会熔化
C. 当食盐温度达到其熔点且继续加热时,食盐才会熔化


 D.以上说法都不正确
D.以上说法都不正确


 3.如图1-39所示是萘熔化的图像,从图中可以看出80℃的萘是 ( D
)
3.如图1-39所示是萘熔化的图像,从图中可以看出80℃的萘是 ( D
)






 A.固态 B.液态 C. 固液共存 D.以上几种情况都有可能
A.固态 B.液态 C. 固液共存 D.以上几种情况都有可能
2.

 了解晶体形成的几种方法。
了解晶体形成的几种方法。
1.

 能说出晶体与非晶体的主要区别。
能说出晶体与非晶体的主要区别。
1.

 8 物质在水中的结晶
8 物质在水中的结晶


 学习目标
学习目标
7.

 有一包固体混合物,含有硝酸钠和不溶性杂质,在一定量的水中加热,充分溶解。测试结果如表一:
有一包固体混合物,含有硝酸钠和不溶性杂质,在一定量的水中加热,充分溶解。测试结果如表一:
|
温度(℃) |
10 |
40 |
75 |
|
剩余固体(克) |
20l |
132 |
72 |
已知硝酸钠在各温度时的溶解度如表二:
|
温度(℃) |
10 |
25 |
40 |
50 |
55 |
60 |
65 |
75 |
80 |
|
溶解度(克) |
8l |
92 |
104 |
114 |
1l7 |
124 |
130 |
150 |
166 |
求:(1)此实验中所用水的质量是多少;


 (2)原固体混合物中含硝酸钠多少;
(2)原固体混合物中含硝酸钠多少;


 (3)要完全溶解固体混合物中的硝酸钠,所需的最低温度是多少。
(3)要完全溶解固体混合物中的硝酸钠,所需的最低温度是多少。


 [解] 本题的突破口是从上表中可知40℃肯定是硝酸钠的饱和溶液,从10℃升温到
[解] 本题的突破口是从上表中可知40℃肯定是硝酸钠的饱和溶液,从10℃升温到


 40℃,在这些水中多溶解了硝酸钠固体的质量是20l克-132克=69克。而从10℃升温到
40℃,在这些水中多溶解了硝酸钠固体的质量是20l克-132克=69克。而从10℃升温到


 40℃,硝酸钠的溶解度增大了104克-81克=23克,即100克水中能多溶解硝酸钠23克,则易得解。
40℃,硝酸钠的溶解度增大了104克-81克=23克,即100克水中能多溶解硝酸钠23克,则易得解。


 (1)设实验所用水的质量为x
(1)设实验所用水的质量为x


 (104克-81克):100克=(201克-132克):x
(104克-81克):100克=(201克-132克):x


 x=300克
x=300克


 (2)设10℃时300克水中已溶硝酸钠的质量为y,
(2)设10℃时300克水中已溶硝酸钠的质量为y,


 100克:81克=300克:y
100克:81克=300克:y


 y=243克
y=243克


 即原固体混合物的总质量为243克+201克=444克
即原固体混合物的总质量为243克+201克=444克


 再设75℃时300克水中最多可溶硝酸钠的质量为z
再设75℃时300克水中最多可溶硝酸钠的质量为z


 100克:150克=300克:z
100克:150克=300克:z


 z=450克>444克
z=450克>444克


 所以75℃时所得溶液一定是不饱和的,最后剩下的72克固体都是不溶性杂质。
所以75℃时所得溶液一定是不饱和的,最后剩下的72克固体都是不溶性杂质。


 则原固体混合物中硝酸钠的质量为444克-72克=372克
则原固体混合物中硝酸钠的质量为444克-72克=372克


 (3)设300克水溶解372克硝酸钠刚好饱和时,硝酸钠的溶解度为S
(3)设300克水溶解372克硝酸钠刚好饱和时,硝酸钠的溶解度为S


 S=
S= ×100克-124克
×100克-124克


 对照表二可知,所需最低温度为60℃。
对照表二可知,所需最低温度为60℃。


 第18课时
第18课时
5.

 图1-38是配制50克质量分数为5%的氯化钠溶液的操作过程示意图:
图1-38是配制50克质量分数为5%的氯化钠溶液的操作过程示意图:






 (1)B操作中应称量氯化钠的质量是 2.5克;
(1)B操作中应称量氯化钠的质量是 2.5克;


 (2)放好砝码和调好游码后,向托盘天平的左盘上加氯化钠时,若指针偏向分度盘的左边,应进行的操作是 减少药品
;
(2)放好砝码和调好游码后,向托盘天平的左盘上加氯化钠时,若指针偏向分度盘的左边,应进行的操作是 减少药品
;


 (3)D操作应选用 100
毫升的量筒(从10毫升、100毫升中选择)。量水时量筒必须放
(3)D操作应选用 100
毫升的量筒(从10毫升、100毫升中选择)。量水时量筒必须放


 平稳,视线要跟量筒内液面的 最低处
保持水平;
平稳,视线要跟量筒内液面的 最低处
保持水平;


 (4)E操作的作用是 加速溶解 。
(4)E操作的作用是 加速溶解 。


 [深化提高]
[深化提高]


 6.用溶质的质量分数为98%的浓H2SO4
25毫升(密度为1.84克/厘米3),配制溶质的质量分数为70%的硫酸溶液(密度为1.60克/厘米3),需加水多少毫升?
6.用溶质的质量分数为98%的浓H2SO4
25毫升(密度为1.84克/厘米3),配制溶质的质量分数为70%的硫酸溶液(密度为1.60克/厘米3),需加水多少毫升?


 [解] 本题中70%的硫酸溶液的密度没用。想一想为什么?
[解] 本题中70%的硫酸溶液的密度没用。想一想为什么?


 25毫升×1.84克/厘米3×98%=(25毫升×1.84克/厘米3+V×1克/厘米3)×70%
25毫升×1.84克/厘米3×98%=(25毫升×1.84克/厘米3+V×1克/厘米3)×70%


 V=18.4厘米3
V=18.4厘米3


 即18.4毫升
即18.4毫升


 [选做题]
[选做题]
4.

 根据溶质质量、溶剂质量的变化情况,以及变化所得的结果,在表中填上相应的文字。
根据溶质质量、溶剂质量的变化情况,以及变化所得的结果,在表中填上相应的文字。
|
溶液中各部分变化情况 |
溶质质量 |
不变 |
不变 |
增加 |
减少 |
|
溶剂质量 |
减少 |
增加 |
不变 |
不变 |
|
|
变化结果 |
溶液质量 |
减少 |
增加 |
增加 |
减少 |
|
溶液浓度 |
变大 |
变小 |
变大 |
变小 |


 [科学探究]
[科学探究]


 一、有关溶液稀释问题的计算
一、有关溶液稀释问题的计算


 1.溶液稀释就是往浓溶液中加溶剂变成稀溶液的过程。
1.溶液稀释就是往浓溶液中加溶剂变成稀溶液的过程。


 2.溶液稀释问题的特点是:稀释前后溶液中溶质质量保持不变,即:浓溶液的质量×浓溶液中溶质的质量分数= 稀溶液的质量×稀溶液中溶质的质量分数 。
2.溶液稀释问题的特点是:稀释前后溶液中溶质质量保持不变,即:浓溶液的质量×浓溶液中溶质的质量分数= 稀溶液的质量×稀溶液中溶质的质量分数 。


 3.由于液体称量比较麻烦而用量筒量取体积比较方便,所以计算时有时会牵涉到溶液的体积,这时要通过 密度
来进行计算(公式为ρ=
3.由于液体称量比较麻烦而用量筒量取体积比较方便,所以计算时有时会牵涉到溶液的体积,这时要通过 密度
来进行计算(公式为ρ= 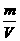 )。
)。


 4.由于分子间存在一定的间隔,所以两种不同液体混合溶解时,体积不能简单相加。(混合后体积 小于
混合前两种液体之和)
4.由于分子间存在一定的间隔,所以两种不同液体混合溶解时,体积不能简单相加。(混合后体积 小于
混合前两种液体之和)


 二、有关溶液浓缩问题的计算
二、有关溶液浓缩问题的计算


 溶液的浓缩问题思考方法可以与稀释问题一样来考虑。
溶液的浓缩问题思考方法可以与稀释问题一样来考虑。


 三、配制一定溶质的质量分数的溶液
三、配制一定溶质的质量分数的溶液


 1.实验步骤:(1)计算;(2)称量;(3)溶解。
1.实验步骤:(1)计算;(2)称量;(3)溶解。


 2.配制50克10%的氯化钠溶液的实验。
2.配制50克10%的氯化钠溶液的实验。


 [典型例题解析]
[典型例题解析]


 [例1] 工业生产上,有时要用溶质的质量分数为10%的稀硫酸来清洗钢材。把50千克溶质的质量分数为98%的浓硫酸稀释成溶质的质量分数为10%的稀硫酸,需要水多少千克?
[例1] 工业生产上,有时要用溶质的质量分数为10%的稀硫酸来清洗钢材。把50千克溶质的质量分数为98%的浓硫酸稀释成溶质的质量分数为10%的稀硫酸,需要水多少千克?


 [解析] 由于稀释前后溶质质量不变。
[解析] 由于稀释前后溶质质量不变。


 设:稀硫酸的质量为x
设:稀硫酸的质量为x


 50千克× 98%=x×10%
50千克× 98%=x×10%


 x=
x= =490千克
=490千克


 则需要水的质量为:490千克-50千克=440千克。
则需要水的质量为:490千克-50千克=440千克。


 [答] 略
[答] 略


 [例2] 配制1 000毫升溶质的质量分数为10%的稀硫酸,需要溶质的质量分数为98%的浓硫酸多少毫升?需要水多少毫升?(硫酸溶液的密度请查阅p.36表)
[例2] 配制1 000毫升溶质的质量分数为10%的稀硫酸,需要溶质的质量分数为98%的浓硫酸多少毫升?需要水多少毫升?(硫酸溶液的密度请查阅p.36表)


 [解析] 查书中表得溶质的质量分数为10%的硫酸溶液的密度为1.07克/厘米3,溶质的质量分数为98%的浓硫酸的密度为1.84克/厘米3。
[解析] 查书中表得溶质的质量分数为10%的硫酸溶液的密度为1.07克/厘米3,溶质的质量分数为98%的浓硫酸的密度为1.84克/厘米3。


 设:需溶质的质量分数为98%的浓硫酸的体积为V
设:需溶质的质量分数为98%的浓硫酸的体积为V


 稀硫酸溶液的质量为:1000毫升×1.07克/厘米3=1070克
稀硫酸溶液的质量为:1000毫升×1.07克/厘米3=1070克


 溶质的质量为:1070克×10%=107克
溶质的质量为:1070克×10%=107克


 所以V×1.84克/厘米3×98%=107克
所以V×1.84克/厘米3×98%=107克


 V=59.3厘米3
V=59.3厘米3


 浓硫酸的质量:59.3厘米3×1.84克/厘米3=109.2克
浓硫酸的质量:59.3厘米3×1.84克/厘米3=109.2克


 加入水的质量:1070克-109.2克=960.8克
加入水的质量:1070克-109.2克=960.8克


 所以加入水的体积为:
所以加入水的体积为: =960.8
=960.8


 厘米3
厘米3


 [答] 略
[答] 略


 [课内练习]
[课内练习]


 1.用溶质的质量分数为40%的浓氢氧化钠溶液(密度为1.43克/厘米3)配制,143克溶质的质量分数为10%的氢氧化钠溶液,需量取40%的氢氧化钠溶液 25
毫升与水(密度为1克/厘米3) 107.25 毫升混合而成。
1.用溶质的质量分数为40%的浓氢氧化钠溶液(密度为1.43克/厘米3)配制,143克溶质的质量分数为10%的氢氧化钠溶液,需量取40%的氢氧化钠溶液 25
毫升与水(密度为1克/厘米3) 107.25 毫升混合而成。


 2.把m克质量分数为a%的NaCl溶液加水稀释,下列图像中正确描述溶液中溶质质量与加水质量关系的是 ( B
)
2.把m克质量分数为a%的NaCl溶液加水稀释,下列图像中正确描述溶液中溶质质量与加水质量关系的是 ( B
)






 3.密度为1.18克/厘米’的浓盐酸(质量分数36%),用100毫升水稀释100毫升浓盐酸,所得稀盐酸的质量分数 ( B
)
3.密度为1.18克/厘米’的浓盐酸(质量分数36%),用100毫升水稀释100毫升浓盐酸,所得稀盐酸的质量分数 ( B
)


 A.等于18% B.大于18% C.小于18% D.无法确定
A.等于18% B.大于18% C.小于18% D.无法确定


 4.配制20%的硫酸溶液490克,需要98%(密度为1.84克/厘米3)的浓硫酸多少毫升?同时需水多少克?
4.配制20%的硫酸溶液490克,需要98%(密度为1.84克/厘米3)的浓硫酸多少毫升?同时需水多少克?


 [解] 设需浓硫酸的体积为V
[解] 设需浓硫酸的体积为V


 V×1.84克/厘米3×98%=490克×20%
V×1.84克/厘米3×98%=490克×20%


 V=54.35厘米3
V=54.35厘米3


 需水体积为=
需水体积为= =390厘米3
=390厘米3


 [课时小结]
[课时小结]


 重点和难点:有关溶液稀释问题的计算。
重点和难点:有关溶液稀释问题的计算。


 课外同步训练
课外同步训练


 [基础过关]
[基础过关]


 1.浓度为10%的食盐溶液100克,将其浓度增加到20%,可采用的方法是 ( D
)
1.浓度为10%的食盐溶液100克,将其浓度增加到20%,可采用的方法是 ( D
)


 A.加入10克食盐固体 B.把溶液中的水蒸发掉一半
A.加入10克食盐固体 B.把溶液中的水蒸发掉一半


 C.加入100克10%的食盐溶液 D.把水蒸发掉50克
C.加入100克10%的食盐溶液 D.把水蒸发掉50克


 2.用浓度为60%的酒精溶液A与25%的酒精溶液B配制成45%的酒精溶液,则A、B溶液的质量比为 ( C
)
2.用浓度为60%的酒精溶液A与25%的酒精溶液B配制成45%的酒精溶液,则A、B溶液的质量比为 ( C
)


 A.1:2 B.2:3 C.4:3 D.3:1
A.1:2 B.2:3 C.4:3 D.3:1


 3.100克A溶液中水的质量分数为98%,现在要使溶液中水的质量分数变为99%,则应加入水的质量为 ( D
)
3.100克A溶液中水的质量分数为98%,现在要使溶液中水的质量分数变为99%,则应加入水的质量为 ( D
)


 A.1克 B.10克 C 50克 D.100克
A.1克 B.10克 C 50克 D.100克


 4.把溶质的质量分数为l0%的硫酸溶液50克浓缩到40克,此时溶液中硫酸的质量分数为 12.5%
。
4.把溶质的质量分数为l0%的硫酸溶液50克浓缩到40克,此时溶液中硫酸的质量分数为 12.5%
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com