
题目列表(包括答案和解析)
2.某同学利用中学化学教材中提供的数据或图表进行如下推理和判断,其中错误的是
A. 依据中和热的数据;推算一定量的H2SO4和NaOH的两种稀溶液反应放出的热量
B. 依据沸点的数据,判断将两种互溶的液态混合物用蒸馏方法分离开来的可能性
C. 依据相对分子质量,一定能判断组成和结构相似的物质熔沸点的高低
D.依据元素的原子结构,可以推知其在元素周期表中的位置
1.我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是 ( )
A.“钴酞菁”的小分子具有胶体的性质
B.纳米材料可以应用于所有化工领域
C.现在纳米器件都是无所不能的胶体
D.此工作实现了利用局域的化学反应来改变和控制分子的物理性质
4.28×10-10m。求
(1)FexO中x值(精确至0.01)为多少?
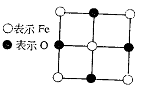 (2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(3)在完整晶体中,与O2-等距且最近的6个Fe占据空隙是何种几何形状?
(4)在晶体中,铁元素的离子间最短距离为多少米
25.(12分)已知Fex O晶体晶胞结构为NaCl型(其晶胞的一个面如图),由于晶体缺陷,x值小于1。测知Fex O晶体密度ρ为5.71 g·cm-3,晶胞边长为:
24.(6分)有一包由硝酸钾和不溶性杂质组成的固体混合物投入一定量的水中,在保证无水分蒸发的前提下,改变温度,测得固体混合物的溶解情况如下:
表一 实验结果
|
温度/℃ |
10 |
40 |
75 |
|
剩余固体/g |
261 |
175 |
82 |
表二 硝酸钾在不同温度时的溶解度
|
温度/℃ |
10 |
40 |
50 |
60 |
65 |
80 |
|
溶解度/g |
20.9 |
63.9 |
85.5 |
110 |
126 |
169 |
|
温度/℃ |
10 |
40 |
50 |
60 |
65 |
80 |
|
溶解度/g |
20.9 |
63.9 |
85.5 |
110 |
126 |
169 |
|
温度/℃ |
10 |
40 |
50 |
60 |
65 |
80 |
|
溶解度/ g |
20.9 |
63.9 |
85.5 |
110 |
126 |
169 |
通过计算回答:
(1)实验过程中所用水的质量是________。
(2)对75℃时所得溶液的下列说法中正确的是
A.该溶液是饱和溶液 B.该溶液是不饱和溶液
C.82g剩余固体中一定含有硝酸钾 D.82g剩余固体中可能含有硝酸钾
(3)原固体混合物中含硝酸钾的质量。
23.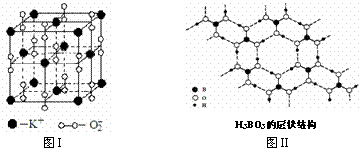 下图表示两种晶体的微观结构:
下图表示两种晶体的微观结构:
试回答下列有关问题:
⑴高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有 个,0价氧原子与-2价氧原子的数目比为 。
⑵正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有 。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中与每个“构成粒子”相邻的粒子呈平面正三角形空间构型。
)
七,(共两小题18分)
22.(12分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶1形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
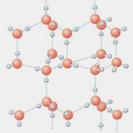 ⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
⑵右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 ,与每个“构成粒子”相邻的粒子呈 空间构型。E与D按原子个数比1∶1形成的化合物的电子式为 。
⑶人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C=D |
D=D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示): 。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c. F的单质
②试估算1mol F单质晶体完全燃烧放出的热量: 。
六,(包括一小题共8分)
21.(12分) 下表是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“……”的四种元素外,其余元素都给出了该种元素的全部该类数据。
|
(H) 13.6 |
|
(He) 24.6 54.4 |
|||||
|
(Li) 5.4 75.6 122.5 |
(Be) 9.3 18.2 153.9 217.7 |
(B) 8.3 25.2 37.9 259.4 340.2 |
(C) 11.3 24.4 47.9 64.5 392.1 489.9 |
(N) 14.5 29.6 47.4 72.5 97.9 552.1 …… |
(O) 13.6 35.1 …… …… …… …… …… …… |
(F) 17.4 34.9 …… …… …… …… …… …… …… |
(Ne) 21.6 41.6 …… …… …… …… …… …… …… …… |
研究这些数据,回答下列问题:
(1)每组数据可能是该元素的________(填序号)
A.原子得到电子所放出的能量 B.原子半径的大小
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素原子的第一个数据:
①总体变化趋势是_______________(填“增大”或“减小”);
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的________________族;
③根据你分析所得的变化规律推测,镁和铝的第一个数据的大小关系为Mg(1)______Al(1)(填“大于”或“小于”)。
(3) 分析每个元素的一组数据:
①有些元素的一组数据中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_____________________________________________________的结论。
②根据这个规律,你认为氧元素8个数据中出现“突跃”的数据应该是第_____个
(每空2分,共12分 )
20.(10分)6 mol的BrFm跟10 mol水恰好完全反应,可以得到氢氟酸以及等物质的量的溴酸、溴单质和氧气。试写出该反应的化学方程式 ;此反应的氧化剂是 ,还原剂是 。当有10mol水参加反应,被水还原的BrFm为 mol。
19.(8分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
⑴钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K3H6U2V2O15(其中钒元素的化合价为+5价)。若用氧化物的形式表示,该化合物的化学式为______。
⑵测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成V02+,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式。
___VO2++____H2C2O4→___VO++___CO2+___H2O
其中还原剂是____;若反应消耗0.9 g草酸,参加反应的钒元素质量是_______g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com