
题目列表(包括答案和解析)
15.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
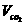 (标况) (标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0 mol·L-1 B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量 D.15.7g混合物不能与盐酸完全反应
14.A、B、C、D为原子序数依次增大的同周期的短周期元素。已知A、C、D三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是
A.A、C、D三种元素最高价氧化物对应水化物有两种是强碱、一种是强酸,或两种是强酸、一种是强碱 B.A、C、D三种元素有两种是金属、一种是非金属
C.D元素在第三周期第ⅥA族 D.A、B、C三种元素的单质熔、沸点依次降低
13.对于达平衡的可逆反应X+Y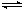 W+Z,增大压强则正、逆反应速率(v)的变化如图,分析可知X、Y、Z、W的聚集状态可能是
W+Z,增大压强则正、逆反应速率(v)的变化如图,分析可知X、Y、Z、W的聚集状态可能是
A. Z,W为气体,X,Y中之一为气体 B. Z,W中之一为气体,X,Y为非气体
C. X,Y,Z,W皆为气体 D. X,Y为气体,Z,W中之一为气体
12.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入NaOH溶液并微热,生成使湿润的蓝色石蕊试纸变红的气体,可确定有NH4+存在
B.加入Ba(NO3)2溶液生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42‑存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
 D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
11.下列离子方程式书写正确的是
A.将6molCl2通入含有5molFeI2的溶液中:6Cl2+2Fe2++10I-= 12Cl-+5I2+2Fe3+
B.4mol·L-1的NaAlO2溶液和10mol·L-1的HCl溶液等体积混合均匀:4AlO2-+ 7H+ + H2O = 3Al(OH)3↓+ Al3+
C.向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO
D.电解饱和MgCl2溶液:2Cl‑+2H2O = 2OH-+H2↑+Cl2↑
10.下列实验不能达到预期目的的是
|
序号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定同浓度Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的酸性强弱 |
9.下列褪色过程不是因为氧化还原反应而褪色的是
A.SO2气体通入到溴水中使溴水褪色。B.氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红。
C.将SO2气体通入到滴有酚酞的NaOH溶液中,溶液褪色。
D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去。-
8.某无色气体可能含有H2S、SO2、CO2、HI、HCl气体中的一种或几种。将气体通入氯水后得无色溶液,向该溶液中滴加氯化钡溶液产生白色沉淀。则下列叙述正确的是
A.该气体中肯定含有SO2 B.该气体中肯定含有H2S和SO2
C.该气体中肯定含有CO2和SO2 D.该气体中肯定含有H2S、CO2和HI
7.组成为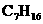 的烷烃有九种,其中仅能由一种单烯烃加氢而制得的有
的烷烃有九种,其中仅能由一种单烯烃加氢而制得的有
A.1种 B.2种 C.3种 D.4种
6.被誉为“太空金属”的钛,在室温下,不与水、稀硫酸、稀盐酸和稀硝酸作用,但易溶于氢氟酸,其原因可能是
A.氢氟酸的酸性比其它酸强 B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强 D.钛离子易与氟离子形成可溶性难电离物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com