
题目列表(包括答案和解析)
1.金属钛对人体无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关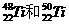 的说法中正确的是 ( )
的说法中正确的是 ( )
A.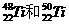 原子中均含有22个中子
原子中均含有22个中子
B.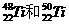 在周期表中位置相同,都在第4纵行
在周期表中位置相同,都在第4纵行
C.分别由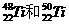 组成的金属钛单质物理性质相同
组成的金属钛单质物理性质相同
D.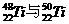 为同一核素
为同一核素
27. (10分)
(10分)
(1)I.短周期某主族元素M的电离
能情况如右图(A)所示。则M元
素位于周期表的第 族。
II.图B折线c可以表达出第 ___ 族
元素氢化物的沸点的变化规律。
两位同学对某主族元素氢化物的沸点
的变化趋势画出了两条折线a和b,你认为正确的是: ______(填“a”或“b”);
Ⅲ.部分有机物的熔沸点见下表:
|
烃 |
CH4 |
CH3CH3 |
CH3(CH2)2CH3 |
硝基苯酚 |
 |
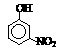 |
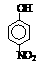 |
|
沸点 |
-164 |
-88.6 |
-0.5 |
熔点/℃ |
45 |
96 |
114 |
由这些数据你能得出的结论是(任写2条): ______ ,______________ 。
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有
(填字母):a.2个σ键;b.2个π键;c.1个σ键、1个π键。
26.(10分)以下由A→G的合成路线叫做“Krohnke反应”:
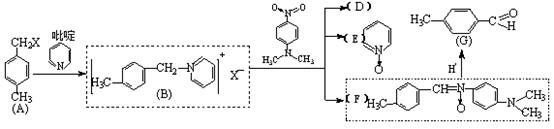

A物质中与苯环相连的“-CH2X”叫做“苄基”。请回答下列问题:
(1)物质A在酸性KMnO4溶液中两个侧链均可被氧化,其有机产物的名称叫做 ________ ;把A与NaOH水溶液共热,所得到的有机产物的结构简式为 。
(2)反应②产物中D物质的化学式为 ;用足量的H2还原吡啶,所得的产物的结构简式为 。(以上每空1分)
(3)物质G与银氨溶液反应的化学方程式为: 。(2分)
(4)物质A与烧碱溶液共热的反应类型属于 反应,产物B的水溶性为 (填:可溶于水、或不溶于水)。(每空1分)
(5)对比问题(1)的两个反应,“Krohnke反应”在有机合成中的作用是: 。(2分)
25、 (9分)2008年10月8日,瑞典皇家科学院宣布将诺贝尔
(9分)2008年10月8日,瑞典皇家科学院宣布将诺贝尔
化学奖授予日本科学家下村修、美国科学家马丁·沙尔菲与美
籍华裔科学家钱永健,以表彰三人因在发现和研究绿色荧光蛋白方面做出的贡献。蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在14%~18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成(NH4)2SO4。
Ⅱ.(NH4)2SO4在凯氏定氮器中与碱作用,蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅱ步生成(NH4)2B4O7的离子方程式为: __________________。(2分)
(2) 乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。
不法分子通过在低蛋白含量的奶粉中加入三聚氰胺(Melamine)来“提高”奶粉中的蛋
白质含量,导致许多婴幼儿肾结石。
①三聚氰胺的结构如图所示,其化学式为__,含氮量(氮元素的质量分数)为__;(各1分)
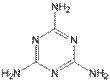 ②下列关于三聚氰胺的说法中,正确的有_____(填序号,多选扣分);(3分)
②下列关于三聚氰胺的说法中,正确的有_____(填序号,多选扣分);(3分)
A. 三聚氰胺是一种白色结晶粉末,没有什么气味和味道,
所以掺入奶粉后不易被发现
B. 三聚氰胺分子中所有原子可能在同一个平面上
C. 三聚氰胺易溶于冷水,属于分子晶体
D. 三聚氰胺呈弱碱性,可以和酸反应生成相应的盐
E. 采用三聚氰胺制造的食具一般都会标明“不可放进微波炉使用”
③假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白质含量为0的假奶粉中掺入________g的三聚氰胺就可使奶粉“达标”。(2分)
24、(12分,每空2分)在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4  2 NO2 ΔH>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
2 NO2 ΔH>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C使用高效催化剂 D.升高温度
 (5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该
图中补画出该反应在60℃时N2O4物质的量的变化曲线。
23、(12分,每空2分)七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
|
pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
|
温度 / ℃ |
10 |
30 |
40 |
50 |
60 |
|
CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
|
MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
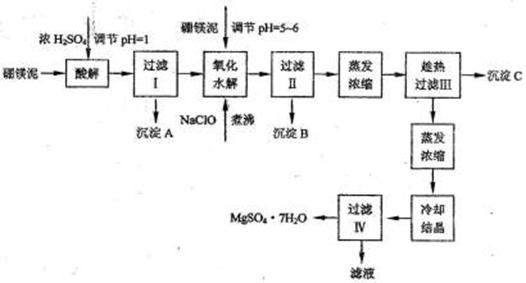
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤Ⅲ需趁热过滤的理由是
22、(9分)已知主族元素X、Y、Z、W是分布于元素周期表中三个短周期里的非金属元素,其原子序数依次增大。W原子的质子数是Y原子质子数的两倍,X原子与W原子的最外层电子数之和是Y和Z原子的质子数之和的1/3。Y的氢化物分子中有三个共价键。
(1)Y的氢化物分子属于 分子(填“极性”或“非极性”),Y的氢化物的沸点比相邻同主族元素氢化物的沸点高,其原因是 。Y的氢化物与质子反应的产物的电子式为 ,此产物的空间形状呈 。
(2)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式,任写3种)
, .
(3)我国材料学家已成功制备了W元素与Y元素组成的耐高温的新型材料W3Y4。工业上可用W的氢化物与Y的氢化物反应制得该耐高温化合物和氢气,此反应的化学方程式为:
.(2分,其余每空1分)
21、(13分)下面是甲、乙两同学对草酸受热分解及其产物的检验做的探究:甲、乙两同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
|
名称 |
分子式 |
颜色、状态 |
溶解性 |
熔点(℃) |
密度(g/cm3) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
189.5 |
1.900 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
1.650 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。
(1)猜想与假设:第一种:草酸分解产物是CO2和H2;
第二种:草酸分解产物是CO2、CO和H2O;
第三种:草酸分解产物是CO2和H2O。
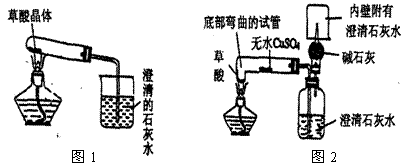 (2)实验装置的设计(图中铁架台略去)甲同学设计了如图1所示的装置。乙同学设计了如图2所示的装置。
(2)实验装置的设计(图中铁架台略去)甲同学设计了如图1所示的装置。乙同学设计了如图2所示的装置。
(3)实验:甲同学按图(1)装置实验,观察到澄清石灰水变浑浊,……
乙同学按图(2)装置实验,观察到:A、无水CuSO4变蓝;B、广口瓶中澄清石灰水变浑浊;C、生成的气体通过碱石灰后,在尖嘴处点燃后能燃烧,在火焰上方罩一个内壁附有澄清石灰水的烧杯,澄清的石灰水变浑浊。证明产物中有 。(2分)
(4)结论:第___种猜想是正确的,请写出草酸受热分解的化学反应方程式 __(共3分)
(5)反思与评价:乙同学认为甲同学设计的实验装置有缺陷。由于试管口向下倾斜,而且草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中常会出现熔融的草酸流进导管而影响后续实验。甲同学认为乙同学的设计是科学合理的。请你谈谈图2装置优于图1装置之处:
第一点: 。(2分)
第二点: 。(2分)
第三点: 。(2分)
乙同学设计的图2装置也能证明产物中无H2,证明方法是 (2分)
20、(10分,每空1分)某同学在探究废干电池内的黑色固体回收利用时,进行如图示实验:
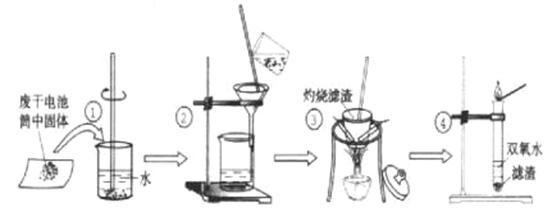
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 ;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气
体,据此可初步认定黑色固体为 。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测
滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
|
实验目的 |
操作 |
实验现象 |
结论 |
|
1、检验Cl- |
取少许滤液于试管中, |
|
含有Cl- |
|
2、检验NH4+ |
取少许滤液于试管中, - |
|
含有NH4+ |
|
3、检验Zn2+ |
取少许滤液于试管中,加入 稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是: 。通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,可用 法。
19、(12分,每空2分)已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。

(1)步骤1的主要操作是 ,需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,
固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com