
题目列表(包括答案和解析)
8、 中考资源网溶质的质量分数的计算
中考资源网
中考资源网溶质的质量分数= =
中考资源网溶液加水稀释前后:m浓 X 浓溶液中溶质的质量分数=m稀 X 稀溶液中溶质的质量分数
中考资源网m前=m后
中考资源网浓溶液变成稀溶液需加水的质量为
中考资源网
中考资源网★下列各组硝酸钾溶液中,硝酸钾的质量分数不等于10%的是( )
中考资源网 A、50g的硝酸钾溶于450g水中
中考资源网B、0.5g 硝酸钾溶于4.5g 水中
中考资源网C、0.01kg硝酸钾溶于100mL水中
中考资源网D、10kg硝酸钾溶于90kg水中
中考资源网★从100克10%的氯化钠溶液中取出20克溶液,其质量分数为( )
中考资源网 A、2% B、20% C、10% D、5%
中考资源网★20℃时氯化钠的溶剂度是36克,在此温度下,配制的氯化钠溶液的溶质质量分数是( )
中考资源网A 36% B 25% C 36.5% D 不能确定
中考资源网★把100mL浓度为35%的浓盐酸稀释5510倍,则稀释后溶液中所含溶质的质量是( )。
中考资源网A.减小l0倍 B.增大10倍 C.增大11倍 D.不会变化
中考资源网
中考资源网★①现有不饱和的硝酸钾溶液,在恒温及溶剂质量不变的条件下,向其中加入硝酸钾晶体,则加入质量与溶液中溶质的质量分数变化的函数图正确的是( )
中考资源网②保持温度不变,在100克水中逐渐加入硝酸钾晶体,则加入的硝酸钾质量与溶液的质量分数变化函数图像正确的是( )
中考资源网 (横坐标表示加入硝酸钾的质量,纵坐标表示A溶液中溶质的质量分数)
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网11、配制一定溶液的溶质质量分数。
中考资源网★某学生配制100克质量分数为5%的氯化钠溶液,其全部过程如下图所示。按要求填空:
中考资源网⑴、配制过程中需要实验器材:
中考资源网⑵计算配制此溶液需要氯化钠 克,水为 毫升。
中考资源网用称取所需要的氯化钠,放入烧杯中;用量取所需的水,并倒入盛有氯化钠的烧杯中,用玻璃棒搅拌。待氯化钠完全溶解时,5%的氯化钠溶液就配制好了。
中考资源网⑶玻璃棒的作用是
中考资源网⑷请概括出该实验的三个步骤,并指出图中的错误:
中考资源网
 ①第一步: , ②第二步: ,③第三步:
。
①第一步: , ②第二步: ,③第三步:
。
中考资源网 图中错处: 。(答出一点即可)
中考资源网11、关于溶液质量分数的计算题型
中考资源网★20℃时,5克食盐放入100克水中充分溶解后,溶质质量分数为 。
中考资源网★20℃时,5克食盐放入5克水中充分溶解后,溶质质量分数为 。
中考资源网★某温度下,将某物质溶液恒温蒸发10克水,析出6克固体;再恒温蒸发15克水,又析出12克固体。则此温度下,该物质的溶解度是 。
中考资源网★在一定温度时,食盐饱和溶液的质量是12克,把它蒸干后,得食盐3.2克,计算该溶液溶质的质量分数是多少?
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网★把100g质量分数为15%的硝酸钾溶液和50g质量分数为40%的硝酸钾溶液混合,所得溶液中溶质的质量分数为多少?
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网★把50千克溶质的质量分数为98%的浓硫酸稀释成溶质的质量分数为10%的稀硫酸,需要水多少千克?
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网★配制20%的硫酸溶液490克,需要98%(密度为1.84克/厘米3)的浓硫酸多少毫升?同时需要水多少克?
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网★现有溶质的质量分数为10%的氯化钠溶液100克,欲使其质量分数变为20%,可采取哪些措施?请列式计算。
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网
中考资源网★用溶质的质量分数为98%的浓硫酸25毫升(密度为1.84克/厘米3),配制溶质的质量分数为70%的硫酸溶液(密度为1.60克/厘米3),需加水多少毫升?
中考资源网
9、影响固体溶解大小的因素有 、 和 ,而与溶质、溶剂的量的多少无关
中考资源网★固体物质的溶解度大小跟下列哪一因素无关( )
中考资源网A、溶剂的种类 B、溶质的种类 C、溶剂的量 D、温度
中考资源网★将20℃时的氯化铵饱和溶液升至50℃(不考虑水的蒸发),一定发生改变的是( )
中考资源网A、溶液的质量 B、溶质的质量分数 C、溶质的质量 D、氯化铵的溶解度
中考资源网★固体溶解度曲线上任意一点表示( )
中考资源网A、溶液达到饱和时溶质的克数
中考资源网B、该温度下,一定量的溶剂里最多能溶解溶质的克数
中考资源网C、该温度下,100克溶剂里最多能溶解溶质的克数
E、 中考资源网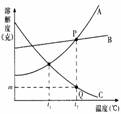 无任何意义
无任何意义
中考资源网
中考资源网★根据右图所示的物质溶解度曲线图,回答以下问题:
中考资源网(1)当温度高于t2℃时,A、B、C三种物质溶解度由小到大的顺序是 ;
中考资源网(2)P点表示 ;
中考资源网(3)A、B、C的溶解度为B>A>C的温度范围是 ;
中考资源网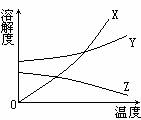
中考资源网★图中示出的是三种物质X、Y、Z的溶解度曲线。当它们的溶液接近饱和时,分别通过加溶质、蒸发、升温三种手段均可使之变为饱和的是( )
中考资源网A、X溶液 B、Y溶液 C、Z溶液 D、X、Y混合溶液
中考资源网
15. 为研究A物质溶液的性质,可进行以下步骤的实验:①称量容器为ag;②将一定量A的溶液倒入容器,称量为bg;③将容器放入恒温箱内,在温度为t℃时进行恒温蒸发;④当观察到溶液刚开始微量结晶时,迅速取出容器,冷却后称量为cg;⑤继续加热蒸发并用余热蒸干,称量为dg。
为研究A物质溶液的性质,可进行以下步骤的实验:①称量容器为ag;②将一定量A的溶液倒入容器,称量为bg;③将容器放入恒温箱内,在温度为t℃时进行恒温蒸发;④当观察到溶液刚开始微量结晶时,迅速取出容器,冷却后称量为cg;⑤继续加热蒸发并用余热蒸干,称量为dg。
 试求:
试求:
 (1)容器内溶质A的质量为___________。
(1)容器内溶质A的质量为___________。
 (2)原溶液中溶质A的质量分数___________。
(2)原溶液中溶质A的质量分数___________。
 (3)溶液刚开始微量结晶时,剩余溶液的质量约为___________。
(3)溶液刚开始微量结晶时,剩余溶液的质量约为___________。
 (4)温度为t℃时,溶质A(不含结晶水)的溶解度约为___________。
(4)温度为t℃时,溶质A(不含结晶水)的溶解度约为___________。
 16.把50g溶质质量分数为98%的硫酸稀释成溶质质量分数为20%的硫酸溶液,需加水多少克?
16.把50g溶质质量分数为98%的硫酸稀释成溶质质量分数为20%的硫酸溶液,需加水多少克?

6. 下表是硫酸密度与溶质的质量分数的对照表(20℃),查表计算下列各题。
下表是硫酸密度与溶质的质量分数的对照表(20℃),查表计算下列各题。
|
密度g·cm-3 |
1.14 |
1.30 |
1.50 |
1.73 |
1.84 |
|
质量分数 |
20% |
40% |
60% |
80% |
98% |
(1)10mL98%的硫酸中含纯硫酸___________克。
 (2)配制20%硫酸溶液450g,需要60%的硫酸___________mL。
(2)配制20%硫酸溶液450g,需要60%的硫酸___________mL。
 7.在80g质量分数为15%的硝酸钠溶液里:
7.在80g质量分数为15%的硝酸钠溶液里:
 (1)含硝酸钠___________g,水___________g。
(1)含硝酸钠___________g,水___________g。
 (2)若取出该溶液20g,则其含硝酸钠___________g,水___________g。
(2)若取出该溶液20g,则其含硝酸钠___________g,水___________g。
 (3)若加入20g水,则溶质的质量分数为___________。
(3)若加入20g水,则溶质的质量分数为___________。
 (4)若加入20g硝酸钠,则溶质质量分数为___________。
(4)若加入20g硝酸钠,则溶质质量分数为___________。
 (5)若蒸发掉20g水(无晶体析出),则溶质的质量分数为 。
(5)若蒸发掉20g水(无晶体析出),则溶质的质量分数为 。
 8.下列叙述中,正确的是(
)。
8.下列叙述中,正确的是(
)。
 A.饱和溶液一定是浓溶液
A.饱和溶液一定是浓溶液
 B.饱和溶液降温一定会析出晶体
B.饱和溶液降温一定会析出晶体
 C.稀溶液也可能是饱和溶液
C.稀溶液也可能是饱和溶液
 D.饱和溶液中不能再溶解其他溶质
D.饱和溶液中不能再溶解其他溶质
 9.在一定温度下,某物质的饱和溶液一定是 ( )。
9.在一定温度下,某物质的饱和溶液一定是 ( )。
 A.非常浓的溶液
A.非常浓的溶液
 B.投入该溶液的固体溶质,还能继续溶解的溶液
B.投入该溶液的固体溶质,还能继续溶解的溶液
 C.含溶质少的溶液
C.含溶质少的溶液
 D.增加该溶液的固体溶质,质量不再增加的溶液
D.增加该溶液的固体溶质,质量不再增加的溶液
 10.测定某温度下某物质的溶解度时,所用溶液必须是( )。
10.测定某温度下某物质的溶解度时,所用溶液必须是( )。
 A.浓溶液 B.饱和溶液 C.稀溶液 D.不饱和溶液
A.浓溶液 B.饱和溶液 C.稀溶液 D.不饱和溶液
 11.在室温时,将50g某物质的饱和溶液蒸干,得到0.15g不含结晶水的晶体,则该物质是
( )。
11.在室温时,将50g某物质的饱和溶液蒸干,得到0.15g不含结晶水的晶体,则该物质是
( )。
 A.易溶物质 B.可溶物质 C.难溶物质 D.微溶物质
A.易溶物质 B.可溶物质 C.难溶物质 D.微溶物质
 12.在20℃时,A、B、C三种物质的溶解度分别是50g、40g、30g,则此温度下三种物质的各100g饱和溶液中,所含溶剂的质量由多到少的顺序是 ( )。
12.在20℃时,A、B、C三种物质的溶解度分别是50g、40g、30g,则此温度下三种物质的各100g饱和溶液中,所含溶剂的质量由多到少的顺序是 ( )。
 A.A>B>C B.A>C>B C.B>A>C D.C>B>A
A.A>B>C B.A>C>B C.B>A>C D.C>B>A
 13.ag物质溶解于bg水中,所得溶液的质量分数为( )。
13.ag物质溶解于bg水中,所得溶液的质量分数为( )。
 A.等于
A.等于  ×100% B、小于
×100% B、小于  ×100%
×100%
 C.大于
C.大于  ×100% D.以上情况均有可能
×100% D.以上情况均有可能
 14.从100g20%的氢氧化钠不饱和溶液中蒸发出10g溶剂后,无晶体析出,剩余溶液中溶质的质量分数为( )。
14.从100g20%的氢氧化钠不饱和溶液中蒸发出10g溶剂后,无晶体析出,剩余溶液中溶质的质量分数为( )。
 A.5.6% B.10.5% C.11.2% D.22.2%
A.5.6% B.10.5% C.11.2% D.22.2%
3. 饱和溶液与不饱和溶液转化的方法。
饱和溶液与不饱和溶液转化的方法。
 大多数溶液:
大多数溶液:
 饱和溶液
饱和溶液 不饱和溶液。 “饱和与不饱和溶液”“浓与稀溶液”之间的区别:微溶和难溶的物质,其饱和溶液中溶质的质量分数很小,因此就不会是浓溶液。而易溶的物质,虽然不是饱和溶液,但溶液中溶质的质量分数却比较大。所以饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。
不饱和溶液。 “饱和与不饱和溶液”“浓与稀溶液”之间的区别:微溶和难溶的物质,其饱和溶液中溶质的质量分数很小,因此就不会是浓溶液。而易溶的物质,虽然不是饱和溶液,但溶液中溶质的质量分数却比较大。所以饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。
 4.溶解度。
4.溶解度。
 (1)定义 在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
(1)定义 在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
 在正确理解溶解度概念时,要抓住以下关键的要素:
在正确理解溶解度概念时,要抓住以下关键的要素:
 条件--“在一定温度下”,因为固态物质的溶解度的大小是受温度影响的,所以,谈溶解度必须指明温度。
条件--“在一定温度下”,因为固态物质的溶解度的大小是受温度影响的,所以,谈溶解度必须指明温度。
 标准--“在100g溶剂里(一般指水)”,因为在一定温度下,物质溶解的多少与溶剂的量是成正比的。所以,规定100g溶剂这个统一标准,如不注明,溶剂通常就指水。
标准--“在100g溶剂里(一般指水)”,因为在一定温度下,物质溶解的多少与溶剂的量是成正比的。所以,规定100g溶剂这个统一标准,如不注明,溶剂通常就指水。
 状态--“溶液达到饱和状态”,就是指物质的溶解达到最大量。
状态--“溶液达到饱和状态”,就是指物质的溶解达到最大量。
 单位--“溶解的克数”,溶解度是有单位的,单位是克,不是任何别的单位。必须满足以上四点,才能构成溶解度的完整概念。例如:40℃时,100g水中溶解氯化铵45.8g,刚好达到饱和,则40℃时,氯化铵的溶解度是45.8g。
单位--“溶解的克数”,溶解度是有单位的,单位是克,不是任何别的单位。必须满足以上四点,才能构成溶解度的完整概念。例如:40℃时,100g水中溶解氯化铵45.8g,刚好达到饱和,则40℃时,氯化铵的溶解度是45.8g。
 在一定温度时,溶解度的数学表达式为:
在一定温度时,溶解度的数学表达式为:
 溶解度(g)=
溶解度(g)=  ×100(g)(溶剂)
×100(g)(溶剂)
 5.溶质的质量分数。
5.溶质的质量分数。
 (1)定义:溶质的质量分数是溶质质量与溶液质量之比。
(1)定义:溶质的质量分数是溶质质量与溶液质量之比。
 (2)计算公式:溶质的质量分数=
(2)计算公式:溶质的质量分数=  ×100%,
×100%,
 6.溶解度与质量分数。
6.溶解度与质量分数。
 (1)溶解度与质量分数的比较。
(1)溶解度与质量分数的比较。
|
比较项目 |
溶解度 |
溶质的质量分数 |
|
意义 |
表示物质溶解性的度量,受外界温度、压强等影响 |
表示溶液中溶质质量的多少,不受外界条件限制 |
|
温度要求 |
一定 |
不一定 |
|
溶剂量要求 |
100g |
不一定 |
|
溶液是否饱和 |
一定达到饱和 |
不一定 |
|
单位 |
g |
|
|
关系式 |
溶解度= ×100g |
溶质的质量分数=×100g |
 (2)溶解度与质量分数的换算。
(2)溶解度与质量分数的换算。
 溶解的质量分数=
溶解的质量分数=  ×l00%
×l00%
 溶解度=
溶解度=  ×100g(条件:饱和溶液)
×100g(条件:饱和溶液)
 [例1] 判断正误,错误的请改正。
[例1] 判断正误,错误的请改正。
 (1)将一瓶接近饱和的硝酸钾溶液变为饱和溶液可以加水。
(1)将一瓶接近饱和的硝酸钾溶液变为饱和溶液可以加水。
 (2)浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
(2)浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
 (3)酒精与水不可能形成饱和溶液。
(3)酒精与水不可能形成饱和溶液。
 (4)20℃时1g氢氧化钙投入10g水中,充分搅拌静置一段时间,则上层清液为20℃的饱和溶液。
(4)20℃时1g氢氧化钙投入10g水中,充分搅拌静置一段时间,则上层清液为20℃的饱和溶液。
 [分析和解] (1)错误,任何饱和溶液或不饱和溶液加溶剂后,都将成为不饱和溶液。将硝酸钾的不饱和溶液可通过降温、加硝酸钾、蒸发水分到不再溶解硝酸钾为止而形成硝酸钾的饱和溶液。
[分析和解] (1)错误,任何饱和溶液或不饱和溶液加溶剂后,都将成为不饱和溶液。将硝酸钾的不饱和溶液可通过降温、加硝酸钾、蒸发水分到不再溶解硝酸钾为止而形成硝酸钾的饱和溶液。
 (2)正确,溶液的饱和、不饱和与浓、稀没有必然的联系,“饱和”、“不饱和”是从一定条件下能不能继续溶解溶质的角度分析的,而“浓”、“稀是从一定质量的溶液里含溶质的质量的多少的角度分析的,而两者无必然联系。
(2)正确,溶液的饱和、不饱和与浓、稀没有必然的联系,“饱和”、“不饱和”是从一定条件下能不能继续溶解溶质的角度分析的,而“浓”、“稀是从一定质量的溶液里含溶质的质量的多少的角度分析的,而两者无必然联系。
 (3)正确,因为酒精与水均为液体,且两液体互溶,故不能形成饱和溶液。
(3)正确,因为酒精与水均为液体,且两液体互溶,故不能形成饱和溶液。
 (4)正确,20℃时100g水中加入1g氢氧化钙后充分溶解仍有氢氧化钙未溶,静置后,上层均一稳定的溶液是20℃,不能再溶解氢氧化钙的饱和溶液。
(4)正确,20℃时100g水中加入1g氢氧化钙后充分溶解仍有氢氧化钙未溶,静置后,上层均一稳定的溶液是20℃,不能再溶解氢氧化钙的饱和溶液。
 [例2] 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液,对吗?
[例2] 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液,对吗?
 [分析和解] 不对。饱和溶液与不饱和溶液,浓溶液与稀溶液它们是两种不同的分类方法,是两组完全不同的概念。溶液的饱和与否是指在一定温度下,在一定量的溶剂里,该溶液是否已达到溶解该溶质的最大限度。而溶液的浓和稀,是指在一定量的溶剂中溶解的溶质的量的多与少,它们没有什么必然联系。饱和溶液不一定就是浓溶液,同样,不饱和溶液也不一定就是稀溶液。
[分析和解] 不对。饱和溶液与不饱和溶液,浓溶液与稀溶液它们是两种不同的分类方法,是两组完全不同的概念。溶液的饱和与否是指在一定温度下,在一定量的溶剂里,该溶液是否已达到溶解该溶质的最大限度。而溶液的浓和稀,是指在一定量的溶剂中溶解的溶质的量的多与少,它们没有什么必然联系。饱和溶液不一定就是浓溶液,同样,不饱和溶液也不一定就是稀溶液。
 [例3] 在一定温度下,向质量都是50g的五份水中分别加入30g、40g、50g、60g、70g硝酸钾,充分搅拌后,滤去未溶解的硝酸钾后,加入硝酸钾的质量与相应所得溶液的质量的5组数据如下表:
[例3] 在一定温度下,向质量都是50g的五份水中分别加入30g、40g、50g、60g、70g硝酸钾,充分搅拌后,滤去未溶解的硝酸钾后,加入硝酸钾的质量与相应所得溶液的质量的5组数据如下表:
|
加入硝酸钾的质量/克 |
30 |
40 |
50 |
60 |
70 |
|
溶液质量/克 |
80 |
90 |
100 |
105 |
105 |
求该温度下硝酸钾的溶解度。
 [分析和解] 第4或第5组是饱和溶液
[分析和解] 第4或第5组是饱和溶液
 温度 溶质 + 溶剂 = 饱和溶液
温度 溶质 + 溶剂 = 饱和溶液
 t0 Sg 100g (100+S)g
t0 Sg 100g (100+S)g
 (105-50)g 50g
(105-50)g 50g
 解得S=110g
解得S=110g
 [例4] 含有10%的硝酸钾溶液160g,分为相等的两份。
[例4] 含有10%的硝酸钾溶液160g,分为相等的两份。
 (1)欲使其中一份溶质的质量分数增大一倍,求:
(1)欲使其中一份溶质的质量分数增大一倍,求:
 ①若用增加溶质的方法,需增加多少克硝酸钾。
①若用增加溶质的方法,需增加多少克硝酸钾。
 ②若用蒸发溶剂的方法,需蒸发多少克水。
②若用蒸发溶剂的方法,需蒸发多少克水。
 ③若用60%的硝酸钾溶液与之混合的方法,需加入60%的硝酸钾溶液多少克。
③若用60%的硝酸钾溶液与之混合的方法,需加入60%的硝酸钾溶液多少克。
 (2)若使另一份溶质的质量分数为5%,需加水多少克。
(2)若使另一份溶质的质量分数为5%,需加水多少克。
 [分析和解] 此题是关于溶液的浓缩与稀释问题的有关计算,问题的关键稀释前后,溶液中溶质的质量不变。
[分析和解] 此题是关于溶液的浓缩与稀释问题的有关计算,问题的关键稀释前后,溶液中溶质的质量不变。
 160克硝酸钾溶液分为两等份,每份为80克。
160克硝酸钾溶液分为两等份,每份为80克。
 解:(1)欲使质量分数增大一倍,即变为20%。
解:(1)欲使质量分数增大一倍,即变为20%。
 ①若用加溶质的方法,设需加硝酸钾的质量为x克。
①若用加溶质的方法,设需加硝酸钾的质量为x克。
 80g×10%+x=(80+x)×20%
80g×10%+x=(80+x)×20%
 x=10
x=10
 ②若用蒸发溶剂的方法,设需蒸发水的质量为y克。
②若用蒸发溶剂的方法,设需蒸发水的质量为y克。
 80g×10%=(80-y)·20%
80g×10%=(80-y)·20%
 y=40
y=40
 ③设需加60%的硝酸钾溶液的质量为z克。
③设需加60%的硝酸钾溶液的质量为z克。
 80g+10%+z ×60%=(80+z)·20%
80g+10%+z ×60%=(80+z)·20%
 z=20
z=20
 (2)设使另一份溶质的质量分数变为5%,需加水的质量为A克。
(2)设使另一份溶质的质量分数变为5%,需加水的质量为A克。
 80g×10%=(80+A)·5%
80g×10%=(80+A)·5%
 A=80
A=80
 答:(1)①需加10克硝酸钾;②需蒸发40克水;③需加60%的硝酸钾溶液20克。
答:(1)①需加10克硝酸钾;②需蒸发40克水;③需加60%的硝酸钾溶液20克。
 (2)使另一份溶液中溶质的质量分数变为5%,需加入水80克。
(2)使另一份溶液中溶质的质量分数变为5%,需加入水80克。
 同步冲刺
同步冲刺
 1.现有一瓶接近饱和的硝酸钾溶液,若想使其变为饱和溶液,可采取的方法有:___________;___________;___________。
1.现有一瓶接近饱和的硝酸钾溶液,若想使其变为饱和溶液,可采取的方法有:___________;___________;___________。
 2.20℃时,50g水中达到饱和状态时能溶解A物质30g,若加入25gA,此时溶液是___________,再加入10gA;所得溶液是___________溶液。
2.20℃时,50g水中达到饱和状态时能溶解A物质30g,若加入25gA,此时溶液是___________,再加入10gA;所得溶液是___________溶液。
 3.已知:m<n<w,在一定的温度下,Q克水中最多能溶解ngA物质就形成饱和溶液,现加入wgA物质充分溶解得到的是___________溶液,若加入mgA物质充分溶解,得到的是___________溶液。(填“饱和”与“不饱和”)
3.已知:m<n<w,在一定的温度下,Q克水中最多能溶解ngA物质就形成饱和溶液,现加入wgA物质充分溶解得到的是___________溶液,若加入mgA物质充分溶解,得到的是___________溶液。(填“饱和”与“不饱和”)
 4.已知:熟石灰在水中的溶解度随温度升高而下降,现欲使一饱和石灰水变为不饱和,可采用的方法是___________和___________,若给饱和石灰水加热,产生的现象是_______________________________________________________。
4.已知:熟石灰在水中的溶解度随温度升高而下降,现欲使一饱和石灰水变为不饱和,可采用的方法是___________和___________,若给饱和石灰水加热,产生的现象是_______________________________________________________。
 5.温度为t℃的硝酸钾溶液,恒温蒸发Ag水时,析出晶体ag,再恒温蒸发出Ag水,又析出bg晶体。则:
5.温度为t℃的硝酸钾溶液,恒温蒸发Ag水时,析出晶体ag,再恒温蒸发出Ag水,又析出bg晶体。则:
 (1)析出晶体的质量关系a________b。
(1)析出晶体的质量关系a________b。
 (2)t℃时硝酸钾的溶解度为___________g。
(2)t℃时硝酸钾的溶解度为___________g。



 试一试:将一杯食盐水放在太阳光下一段时间,水蒸发干后,杯底留下什么物质?将一杯70℃时的饱和蔗糖水放在冰箱冷藏室,一段时间后取出观察,你在杯底发现了什么?
试一试:将一杯食盐水放在太阳光下一段时间,水蒸发干后,杯底留下什么物质?将一杯70℃时的饱和蔗糖水放在冰箱冷藏室,一段时间后取出观察,你在杯底发现了什么?







13、


 硝酸钾的溶解度在 20℃时为31. 6克, 30℃时为45.8克。现将218.7克30℃时硝酸钾的饱和溶液降温至20℃,能得到硝酸钾多少克?
硝酸钾的溶解度在 20℃时为31. 6克, 30℃时为45.8克。现将218.7克30℃时硝酸钾的饱和溶液降温至20℃,能得到硝酸钾多少克?

















12、


 氯化钾在10℃时的溶解度为30克,现有500克20%的氯化钾溶液,若使它在10℃时析出10克氯化钾晶体(不含结晶水),则需蒸发的水为多少克?
氯化钾在10℃时的溶解度为30克,现有500克20%的氯化钾溶液,若使它在10℃时析出10克氯化钾晶体(不含结晶水),则需蒸发的水为多少克?
















11、


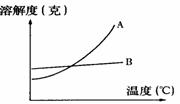
 A和B两种物质的溶解度曲线如图所示,要从A和B 的饱和溶液中得到溶质,该用何种结晶方法?
A和B两种物质的溶解度曲线如图所示,要从A和B 的饱和溶液中得到溶质,该用何种结晶方法?













10、


 有两杯无色的液体,一杯是蒸馏水,另一杯是饱和食盐水,请用三种不同的方法将它们鉴别开,简述操作的方法和得到的结论。
有两杯无色的液体,一杯是蒸馏水,另一杯是饱和食盐水,请用三种不同的方法将它们鉴别开,简述操作的方法和得到的结论。
















湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com