
题目列表(包括答案和解析)
20.(11分)
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10-2)
__________________________________________________________________。
(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
|
KMnO4酸性溶液 的浓度 / mol·L-1 |
溶液褪色所需时间 t
/ min |
||
|
第1次 |
第2次 |
第3次 |
|
|
0.01 |
14 |
13 |
11 |
|
0.001 |
6 |
7 |
7 |
① 计算用0.001 mol·L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化,写出计算过程)。
② 若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:_________________________________
_______________________________________________________________。
19.(11分)
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
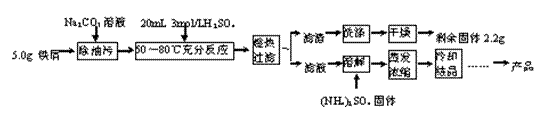
回答下列问题:
(1)Na2CO3溶液可以除油污,原因是(用离子方程式表示)_______________________。
(2)判断铁屑与硫酸基本反应完全的现象是_____________________________________。
(3)某同学认为铁屑与硫酸反应不需精确温度,因此不使用热水浴加热,改用酒精灯断断续续加热维持温度,该做法的不妥之处是_________________________________。
(4)“趁热过滤”后的滤液有时略显黄色,分析其原因是(用离子方程式表示)_______________________________________。
(5)忽略油污质量,本实验中应称量(NH4)2SO4固体的质量为_______g。
(6)若上述流程用于大量生产,“冷却结晶”后的母液最佳处理方法是_______________。
18.向0.50 L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重4.4g,下列说法正确的是 ( )
A.增重的4.4g为参加反应的CO2的质量
B.溶质为Na2CO3
C.溶质为Na2CO3、NaHCO3
D.低温蒸干溶液,所得固体的质量为:原溶液中NaOH的质量 + 4.4g
17.某醋酸溶液与0.01 mol·L-1 NaOH溶液等体积混合(忽略溶液体积变化),混合后溶液显碱性。下列有关叙述不可能出现的是 ( )
A.混合后溶液中:c(CH3COO-) + c(OH-) = c(Na+) + c(H+)
B.该醋酸溶液中:c(H+) = 0.01 mol·L-1
C.该醋酸溶液的物质的量浓度大于0.01 mol·L-1
D.混合溶液中:c(CH3COO-) > c(Na+)
16.下列说法或表示方法正确的是 ( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由H+(aq)+ OH-(aq)= H2O(l) △H = -57.3 kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)= C(金刚石) △H = +1.90 kJ·mol-1可知,金刚石比石墨稳定
D.在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式为 2H2(g)+ O2(g)= 2H2O(l) △H = -285.8 kJ·mol-1
15.保持恒温、恒容,在某密闭容器中发生反应:2A(g)+2B(g)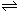 C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ--从正反应开始,A、B的起始物质的量均为2mol ;Ⅱ--从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是( )
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ--从正反应开始,A、B的起始物质的量均为2mol ;Ⅱ--从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是( )
A.Ⅰ、Ⅱ两种途径从反应开始到平衡状态所消耗的时间相同
B.Ⅰ、Ⅱ两种途径从反应开始到平衡状态的过程中,体系的总密度始终保持不变
C.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的物质的量分数相同
D.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的浓度相同
14.X、Y、Z为短周期元素,原子序数依次增大。X的最外层电子数是Y原子最外层电子数的2 倍,质子数比Y少5,X和Z在同一主族。下列叙述不正确的是 ( )
A.原子半径:Y>Z
B.X元素的一种单质可用于消毒杀菌
C.Y的氧化物是工业制取Y单质的主要原料
D.Z的单质在氧气中点燃可生成两种酸性氧化物
13.工业制硝酸的其中一步反应为氨的氧化,反应方程式为:
4NH3(g) + 5O2(g) 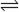 4NO(g) + 6H2O(g) △H=-1025 kJ/mol
4NO(g) + 6H2O(g) △H=-1025 kJ/mol
氧化过程中还伴随有N2O、N2等物质生成。有关该反应的说法正确的是 ( )
A.反应处于平衡状态时,c(NH3)·c(O2)=c(NO)·c(H2O)
B.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施
12.下列化学反应的离子方程式正确的是 ( )
A.碳酸钙溶解于醋酸:CaCO3 + 2H+ = Ca2+ + CO2 + H2O
B.Fe3O4溶解于稀硝酸中:Fe3O4 + 8H+ = 3Fe3+ + 4H2O
C.用烧碱溶液吸收氯气:Cl2 + 2OH- = Cl- + ClO- + H2O
D.石灰乳与MgCl2溶液反应:Mg2+ + Ca(OH)2 = Ca2+ + Mg(OH)2
11.下列关于铜电极的叙述正确的是 ( )
A.铜锌原电池中铜电极上发生氧化反应
B.电解饱和食盐水制烧碱时,用铜作阳极
C.电解法精炼铜时,粗铜连接电源的正极
D.电镀铜和精炼铜时,均用纯铜作阴极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com