
题目列表(包括答案和解析)
3.正确掌握化学用语是学好化学的基础。下列化学用语中正确的是 ( )
A.乙烯的结构简式为CH2CH2 B.葡萄糖的实验式(最简式)为C6H12O6


C.Ca2+的结构示意图为 D.NH4Cl的电子式为
2.下列说法不正确的是 ( )
A.用太阳能蒸馏海水是海水淡化方法之一
B.Na2O2固体中阴阳离子数之比为1:2
C.能源是指能提供能量的自然资源,包括化石燃料、风力、阳光、柴草等
D.标准状况下,78g苯中含有的碳碳双键的物质的量为3mol
1.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是( )
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.NOx、CO、CO2均能与人体中的血红蛋白结合
C.CO在铂表面可能和O2、NOx反应
D.汽车尾气中NOx在铂表面发生反应的产物是N2
27.(10分)
(1)下列现象和应用与电子跃迁无关的是________。
A.激光 B.焰色反应 C.燃烧放热
D.原子光谱 E.霓虹灯 F.石墨导电
(2)A、B、C三种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍,C元素的基态原子L层有两个未成对电子。
① 某直线形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键,_______个π键。
② 由A、B、C三种元素组成的无机阴离子,可形成二聚离子或多聚链状离子,从该阴离子的结构特点分析能够相互缔合的原因:
___________________________________________
_____________________________________________________________。
(3)CO的结构可表示为C≡O,N2的结构可表示为N≡N。下表是两者的键能数据:(单位:kJ/mol)
|
|
A-B |
A=B |
A≡B |
|
C≡O |
357.7 |
798.9 |
1071.9 |
|
N≡N |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:____________________________________
_____________________________________________________________________。
(4)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
① 基态28Ni原子的核外电子排布式为 __ ____ 。
② Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型)。
③ CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) ________________________ 。
26.(10分)
(1)相对分子质量不超过100的有机物X,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。X完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现X的氢谱如下:

① X的分子中含有的官能团名称是__________________________________。
② X的结构简式为___________________________________。
(2)请用合成反应流程图表示出由和其他无机物合成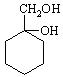 的方案:
的方案:
_________________________________________________________________________________
提示:① 合成过程中无机试剂任选;
② 合成反应流程图表示方法示例如下:
25.(9分)
丙烯和乙烯一样,都是重要的化工原料。由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
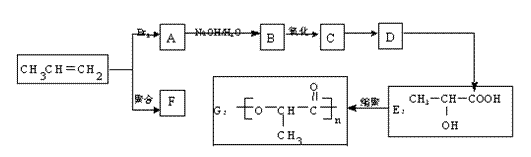
(1)丙烯生成A和F的反应方程式分别为____________________________________、
_________________________________________。
(2)D生成E的反应是原子利用率100%的反应且D不能使溴的四氯化碳溶液褪色,则D的结构简式为_______________________。
(3)一定条件下,两分子E之间脱去一分子水生成一种具有芳香气味的物质。请写出反
应的化学方程式_____________________________________________________。
(4)下列说法不正确的是__________。
A.丙烯没有同分异构体
B.聚丙烯能使酸性高锰酸钾溶液褪色
C.1 mol E与足量金属钠反应可以生成22.4 L氢气(标况)
D.化合物G属于酯类
24.(12分)
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) 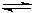 CO (g) +H2 (g) △H= +131.3 kJ•mol-1
CO (g) +H2 (g) △H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
 ① 缩小容器体积(用实线表示)
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器 编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
ν正、ν逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
ν正=ν逆 |
|
Ⅱ |
0.12 |
0.20 |
________ |
ν正=ν逆 |
|
Ⅲ |
0.10 |
0.20 |
0.40 |
ν正____ν逆 |
(5)己知:2C (s) + O2(g) = 2CO (g) △H = -221.0 kJ·mo1-1
2CO(g) + O2(g) = 2CO2 (g) △H = -566.0 kJ·mo1-1
2H2 (g) + O2 (g) = 2H2O (g) △H = -483.6 kJ·mo1-1
若将24 g 炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为 kJ。
23.(12分)
氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
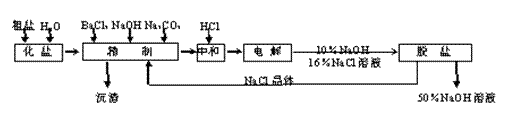
(1)精制过程中反应的离子方程式为____________________________________________
_________________________________________________________。
(2)电解过程的总反应方程式为_________________________________________。
(3)电解槽阳极产物可用于________________________________(至少写出两种用途)。
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
|
温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
NaOH /g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
|
NaCl/ g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐的主要工序应为_______________、_______________。脱盐后的碱液含NaOH约50%,含NaCl仅约2%左右,NaCl能够从溶液中大量析出的原因是
______________________________________________________________________。
22.(10分)
(1)部分短周期元素的原子半径及常见化合价如下表:
|
元素代号 |
M |
Q |
R |
T |
X |
|
原子半径/nm |
0.160 |
0.143 |
0.099 |
0.074 |
0.102 |
|
常见化合价 |
+2 |
+3 |
-1 |
-2 |
+6,-2 |
① R元素的阴离子结构示意图为________________。
② 探究M和Q两种元素金属性强弱的实验方法是________________________
__________________________________________________________________。
③ 工业生产中排放的SO2用饱和Na2XO3溶液吸收可化害为利生产化工原料,该反应的化学方程式为____________________________________________________。若将金属Q的硫酸盐溶液滴加到饱和Na2XO3溶液中,观察到的现象有_____________________________________________________________________。
(2)几种常见弱酸的电离平衡常数(25℃)如下表。
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3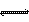 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
|
H3PO4 |
H3PO4 H++H2PO4― - H++H2PO4― -H2PO4―  H++HPO42― H++HPO42― HPO42―  H++PO43- H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
① 若把HCO3-、H2PO4-、HPO42-都看作是酸,则它们的酸性由强到弱的顺序是____________________________________________________。
② 物质的量浓度相同时,Na3PO4溶液的碱性比Na2CO3溶液_______(强 / 弱)。
21.(12分)
某白色粉末可能含有K2SO4、NH4Cl、NaCl。请设计合理实验探究该白色粉末的组成。
限选实验仪器与试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、1mol·L-1硫酸、1mol·L-1硝酸、1mol·L-1盐酸、BaCl2溶液、2mol·L-1NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
完成以下实验探究过程:
(1)提出假设:
根据题意,该白色粉末的组成有______种可能的情况。
(2)设计实验方案
基于该粉末中上述三种盐均存在这一假设,设计出实验方案(不要在答题卡上作答)。
(3)根据②的实验方案,叙述实验操作、预期现象和结论。
|
实验操作 |
预期现象和结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
步骤4: |
|
|
…… |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com