
题目列表(包括答案和解析)
4.以氮化硅(Si3N4)和氧化铝(Al2O3)为原料,采用常压烧结或热压工艺制备赛伦(Sialan)。赛伦的化学通式为Si6-xAlxOxN8-x,以耐高温、高强度、超硬度、耐磨损、抗腐蚀等性能为主要特征,因此,在冶金、机械、光学、医学等领域有重要应用。它属于 ( )
A.新型无机非金属材料 B.金属材料
C.有机高分子材料 D.无机高分子材料
3.下列叙述正确的是 ( )
A.二氧化硅是人类将太阳能转换为电能的常用材料
B.二氧化硫在接触室被氧化成三氧化硫,再在吸收塔内用水吸收制成浓硫酸
C.为检验酸性溶液中的Cl-和SO42-,先加BaCl2溶液,滤去沉淀后再加AgNO3溶液
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
2.下列说法正确的是: ( )
A.16O2与18O2互为同位素,H2O、D2O、T2O互为同素异形体,N60和N2互为同系物。
B.同主族元素的氢化物沸点均随着相对分子质量增大而升高
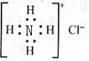 C.在CsCl晶体中,每个Cs+周围与其最近等距离的Cs+为6个。
C.在CsCl晶体中,每个Cs+周围与其最近等距离的Cs+为6个。
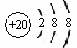 D.Ca2+的结构示意图为
, NH4Cl的电子式为
D.Ca2+的结构示意图为
, NH4Cl的电子式为
1.下列关于环境问题的说法正确的是 ( )
A.pH小于7.0的降雨通常称为酸雨
B.在燃煤中加入适量石灰石,可减少煤燃烧时对空气的污染
C.含磷合成洗涤剂易于被细菌分解,故不会导致水体富营养化
D.水厂常同时加入硫酸亚铁和氯气处理水,能消毒杀菌但不能除去水中悬浮杂质
(下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块内容,请你选择其中一题作答,如果两题均做,则按A题评分。)
21.(12分)
A.四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是___________________________________________________________________。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是_______________________________________________________。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。
 ⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
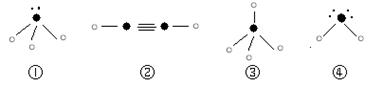
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);
在②的分子中有 个σ键和 个π键。
B.茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。[部分氢氧化物完全沉淀的pH:Ca(OH)2 pH≥13;A1(OH)3 pH≥5.5;Fe(OH)3 pH≥4.1,草酸铵[(NH4)2C2O4]是弱电解质。]

试根据上述过程及信息填空:
⑴步骤①中,使茶叶灰化需要三角架、泥三角、酒精喷灯、________、_______等仪器。
⑵上述实验方案中,检出钙元素的实验步骤是_______________,检出铁元素的实验步
骤是___________,检出铝元素的实验步骤是_______________(填实验步骤编号)。
⑶步骤②中加入6mol∙L-1HCl的作用是_________________________________,步骤⑨作用
是 。
⑷步骤⑧所用A试剂为 。
⑸写出步骤⑥中发生反应的离子方程式__________________________________。
江苏省泰州市2009届高三下学期第一次联考试卷
20.(10分)滴定法是科研和生产中测定溶液中物质浓度的常用方法。
⑴莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银滴定待测液,进而测定溶液中Cl-的浓度, [Ksp(AgCl) =1.56×10-10,Ksp(Ag2CrO4)=1.10×10-12,Ag2CrO4为砖红色]
①滴定终点的现象是_________________;
②已知该滴定适宜的酸度范围是pH 6.5-10.5,且当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5-7.2。下列有关说法你认为合理的有__________。
a.若溶液pH<6.5,则Cr2O72-+H2O 2CrO42-+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42-+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl- 及时释放出来,防止滴定终点提前
⑵氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L--每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72-,实验数据记录如下:
 实验数据
实验数据实验序号 |
FeSO4溶液体积读数/mL |
|
|
滴定前 |
滴定后 |
|
|
第一次 |
0.10 |
16.20 |
|
第二次 |
0.30 |
15.31 |
|
第三次 |
0.20 |
15.19 |
①完成离子方程式的配平:
___Cr2O72-+___Fe2++____ _______ ____Cr3++____Fe3++____H2O
②计算废水样的化学耗氧量。 (写出计算过程,结果精确到小数点后一位。)
19. (12分)盐酸苯海拉明是一种常用的抗过敏药物,其合成线路如下:
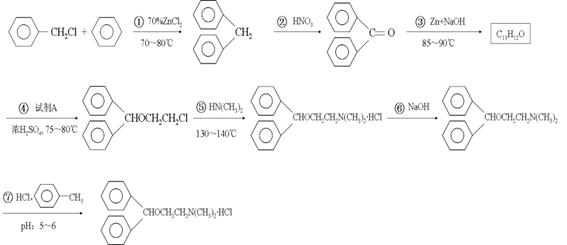
⑴反应①属于___________反应,反应②属于___________反应(填有机反应类型);
⑵反应④的化学方程式为 ;
⑶已知甲醛是一个平面型分子,二苯甲酮分子中最多有______个原子在同一平面上;
⑷C13H12O有多种同分异构体,请写出两种能发生银镜反应的同分异构体的结构简式
、 ;
⑸⑥⑦两步反应的目的是_________________________________;
⑹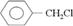 由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获
由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获
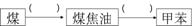
得: 请在括号中填写加工方法或操作名称。
18. (10分)二氧化硫是常用的化工原料,但也是大气的主要污染物。
(10分)二氧化硫是常用的化工原料,但也是大气的主要污染物。
⑴硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)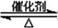 2SO3(g)
2SO3(g)
某温度下,将SO2和O2按体积比2:1充入密闭容器中,SO2的
平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回
答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡
后,体系总压强为0.10MPa。平衡时c(SO3)=___________ mol/L;
②达到平衡状态B,O2的转化率α(O2)=__________。
⑵因为SO2排放造成的环境问题有________。
a.光化学烟雾 b.酸雨 c.赤潮 d.破坏臭氧层
⑶大气中的SO2主要源于化石燃料的燃烧和含硫矿石的冶炼。在SO2污染的治理中湿法石灰石-石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏(CaSO4·2H2O),烟气脱硫后排入大气。
①写出湿法石灰石-石膏法脱硫所涉及的化学反应方程式
, 。
②烟气在通入石灰石的浆液前通过热交换器的目的是 。
17.(8分)高纯超净特种气体主要用于制造半导体器件、化合物半导体、激光器、光导纤维、太阳能电池等。超纯硅化氢制备方法如下:(已知:常温下SiH4难溶于水,与稀硫酸不反应,乙醚沸点34.6℃)
①由下列两种方法制得SiH4
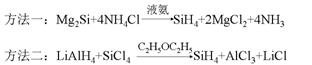
②除去SiH4中混有的杂质气体
请回答下列问题:
⑴对方法一的理解,有同学认为是NH4+水解产生H+,Mg2Si与H+反应生成SiH4,你认为该观点是否正确?并简述理由____________________________________________。
⑵将方法二的固体产物溶于水,只有一种物质能促进水的电离,则NaOH、Mg(OH)2、LiOH碱性由强到弱的顺序为_________________。
⑶两种方法制得的SiH4中均含有少量杂质,有同学提出用下列方法除去SiH4中的杂质,其中肯定不可行是____________。
a.用稀硫酸洗气 b. 高温使杂质分解 c.低温分馏
⑷甲、乙、丙三同学在讨论SiH4制备方法的化学反应类型时发表如下观点,你认为正确的是__________。
a.甲同学认为两个反应均为氧化还原反应
b.乙同学认为两个反应中只有一个属于氧化还原反应
c.丙同学认为要判断是否属于氧化还原反应,还需要知道SiH4中各元素具体的化合价
16.(10分)已知A是一种有机溶剂,F 是一种黄色晶体,N带有磁性,B、F、L、O、P是中学化学常见单质,J的相对分子质量比D大16,A和B反应前后气体体积(常温常压)保持不变,在试管中灼烧固体I,试管底部无固体残留,反应①②③均是化工生产中的重要反应。


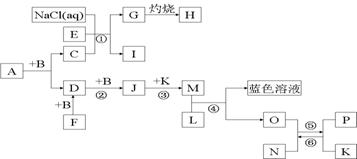
⑴A的结构式___________。
⑵写出反应①的化学方程式______________________________________________。
⑶高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式___________________,
该反应的平衡常数表达式K=___________。
⑷请设计一个实验方案,完成反应④,并在答题卡指定位置绘出实验装置图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com