
题目列表(包括答案和解析)
1.下列离子方程式正确的是
A.过氧化钠和水反应:2O2- 2+2H2O=4OH-+O2↑
B.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-=NH3↑+H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
21.(共12分)
(1)1s22s22p63s23p63d84s2 (2分) (2) C≡O (2分) (3) 分子晶体(2分) 配位键(共价键)(2分) (4)MgCNi3 (2分) 12个(2分)
20.(共10分)(1)BCD(3分) (2)BC(2分) (3)K=16(2分) (4)2.8L
19.(共12分)(1)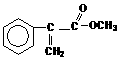 (2) (a) 消去 (b) H
(2) (a) 消去 (b) H 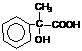
(c) F中含碳碳双键,羟基氧化时可能会同时氧化碳碳双键,使最终不能有效、顺利地转化为B
(d)⑥
⑦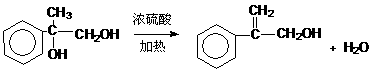
18.(共10分)步骤一: Cu2++2e = Cu (1分);变小(1分)
3Ag + 4H+ + NO3- = 3Ag+ + NO ↑+ 2H2O(2分)
浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中。(2分) 0.5 (2分) 0.1(2分)
17.(共10分)
⑴ 充分利用潮汐能、风能、太阳能等海边富有的洁净能源
⑵ CH2=CHCOONa
⑶ ① SO2+Br2+2H2O=4H++2Br-+SO42- ② 蒸馏
⑷ 苦卤样品的体积、加入NaOH溶液后生成的Mg(OH)2的质量、加入BaCl2溶液后生成的BaSO4的质量
16.(共8分)(1)四(或4);Ⅷ。 (每空1分) (2)1:2(1分) (3)③。(1分)
(4)3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O。(2分)
(5)Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。(2分)
2K2FeO4+3KNO2+2H2O。(2分)
15.(10分)(1)NH4+
+ OH-  NH3↑+
H2O (1分);稀硫酸(1分)
NH3↑+
H2O (1分);稀硫酸(1分)
(2)使硫酸铵充分反应完全转化为NH3 (2分)
[交流讨论] A、B装置间缺一个干燥装置(2分)
缺少赶尽反应装置中残留氨气的装置(2分)
[探究结论]该化肥不是一等品(2分)
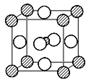
21.(12分)最近,由镁、镍和碳三种元素组成的化合物引起了科学家的注意。
(1)写出镍原子基态的电子排布式 。
(2)写出一氧化碳的结构式 ,
(3)四羰基镍[Ni(CO)4]为无色挥发性剧毒液体。熔点-25℃。沸点43℃。不溶于水,易溶于乙醇、乙醚、苯、四氯化碳等有机溶剂,呈四面体构型。四羰基镍的晶体类型是 ,镍原子和羰基之间的作用力为 。
(4)据报道,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积(ccp)如图,试写出该晶体的化学式 。晶体中每个镁原子周围距离最近的镍原子有 个。

江苏省启东中学2009届高三上学期期末考试
化学评分标准
单项选择题:1、A 2、B 3、D 4、A 5、B 6、D 7、B 8、 B
不定项选择题:9、BC 10、AD 11、D 12、CD 13、B 14、AD
20.(10分)800℃时,在2L密闭容器内充入0.50molNO和0.25molO2 ,发生如下反应:
 2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
|
t(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.50 |
0.35 |
0.28 |
0.25 |
0.25 |
0.25 |
(1)能说明该反应已达到平衡状态的是 。
A、v(NO2)正=v(O2)逆 B、容器内压强保持不变
C、v(NO)逆=2v(O2)正 D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 。
A、适当升高温度 B、缩小反应容器的体积
C、增大O2的浓度 D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K。
(4)将上述反应进行到4s时的混合气体用足量的水吸收,为保证混合气体中NO、NO2全部转化为HNO3,计算还需通入的O2的体积(折算成标准状况)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com