
题目列表(包括答案和解析)
(二)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
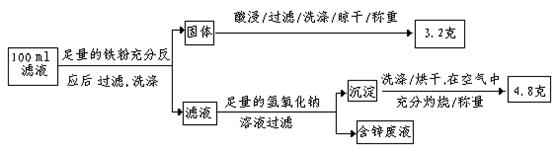
则100mL滤液中:①Cu2+ 的浓度为 mol·L-1 ;②Fe2+的浓度为 mol·L-1。
24.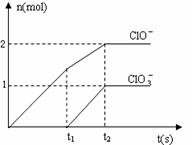 (8分)在一定量的石灰乳中通入一定量
(8分)在一定量的石灰乳中通入一定量
的氯气,二者恰好完全反应(发生的反应
均为放热反应)。生成物中含有Cl-、C1O-、
C1O3-三种含氯元素的离子,其中C1O-、
C1O3-两种离子的物质的量(n)与反应时
间(t)的曲线如右图所示。
(1)t2时,Ca(OH)2与Cl2发生反应的总的化
学方程式为:________________ 。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。在原石灰乳中:
Ⅰ 若通入氯气的速度加快,则反应后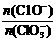 _____2(填“>”、“<”或“=”);
_____2(填“>”、“<”或“=”);
Ⅱ 若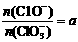 ,则n(C1-)=
mol(用含a的代数式来表示)。
,则n(C1-)=
mol(用含a的代数式来表示)。
江苏省东台市2009届高三上学期期末测试
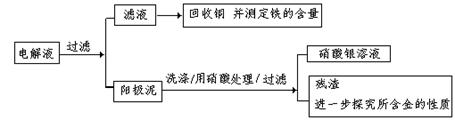
(一)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: ① 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)=
Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl- = AuCl4- |
>>1 |
从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因: ② 。
19.(10分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________ (填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反
应可表示为下图。请在下面的方框中画出离子反应、置换反应(溶液中)和氧化还原反应三者之间的关系。


(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在
下列表格中用相应的“离子方程式”否定这些观点。(不能相同)
|
①所有的离子方程式均可以表示一类反应 |
|
②酸碱中 和反应均可表示为:H++OH-=H2O 和反应均可表示为:H++OH-=H2O |
|
|
③离子方程式中凡是难溶性酸碱盐(产物)均要用“↓” |
|
20.(10分)铼(Re)是自然界中最后一种被诺达克等三位科学家于1926年发现的元素。他们从数以吨计的含有多种元素的矿石中,通过复杂的工艺一点一滴地富集浓缩,才制得了仅2mg的金属铼。现代工业上采用的方法是:在H2流中于800℃的高温下,使高铼酸钾中的铼元素全部被还原出来。
 族 族周期 |
ⅦB |
|
4 |
25Mn锰 |
|
5 |
43Te锝 |
|
6 |
75Re铼 |
(1)根据你的理解,请说明铼元素的发现为什么会如此艰难?时间上为什么会如此漫长?______________________________;_______________________________。
(2)铼有两种天然同位素:稳定同位素185Re和放射性同位素187Re,两个同位素原子中的中子数之和是______________________。
(3)写出现代工业上用氢气还原法制金属铼的化学方程式,并标出电子转移的方向和数目________________________________________。
21.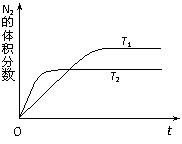 (8分)汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)
(8分)汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
(1)右图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g) 2NO(g)为
(填“吸热”或“放热”)反应。
2NO(g)为
(填“吸热”或“放热”)反应。
(2)2000℃ 时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则 2000℃ 时该反应的平衡常数K= ① 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 ② 。
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。

写出上述变化中的总化学反应方程式: 。
22.(16分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显 ① 性,用离子方程式解释原因 ② 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性: > (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子半径由大到小的顺序是: > > > (用离子符号表示)。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,
并放出QkJ的热量。写出该反应的热化学方程式: 。
23.(12分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下,以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制
请回答以下问题:(1) 电解时,粗铜应与电源的 ① 极相连。阴极上的电极反应式为 ② 。(2) 电解过程中,硫酸铜的浓度会 (填“变大”、“不变”或“变小”)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
18.用酸性氢氧燃料电池电解苦卤水(含Cl-、Br- 、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中不正确的是
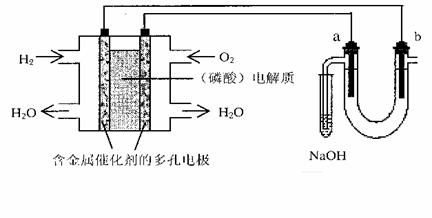
A.电池工作时,正极反应式为:O2 +4H+ + 4e-= 2H2 O
B.电解时,a 电极周围首先放电的是Br-而不是Cl-,,说明当其它条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02g H2时,b 极周围会产生0.02g H2
第Ⅱ卷(非选择题,共64分)
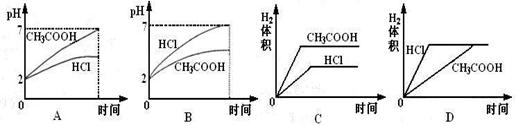
17.在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是
16.2006年11月23日中科院网报道,核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面,取得重要进展─成功地制备出纳米晶体四氧化三铁,为磁性纳米晶体材料在生物医学领域的应用,提供了更广泛的前景。制备纳米晶体四氧化三铁过程如下:
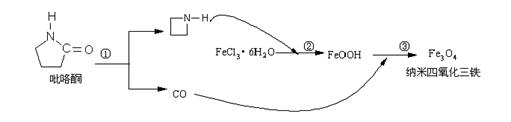
下列有关叙述不合理的是
A.纳米晶体四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.反应③的化学方程式是:6FeOOH +CO = 2Fe3O4 +3H2O + CO2
C.在反应②中环丙胺的作用可能是促进氯化铁水解
D.纳米晶体四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
15.元素A的单质及A与B形成的化合物能按如下图所示的关系发生转化。则下列说法正确的是
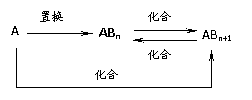
A.图中物质间的转化不都是氧化还原反应 B.当n=1时,A可能是N2
C.A一定是金属元素 D.当n=2时,A可能是Fe
14.500℃、20MPa时,将H2和N2置于一容积为2L的密闭
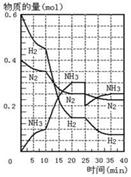 容器中发生反应。反应过程中H2、N2和NH3物质的量变化
容器中发生反应。反应过程中H2、N2和NH3物质的量变化
如右图所示,下列说法不正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为 0.0075mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min时,分离出0.1mol的氨气
D.25min时平衡正向移动,且达到新平衡后NH3的体积分数比原平衡大
13. 韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成 “暖冰”。下列关于“暖冰”的说法不正确的是
韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成 “暖冰”。下列关于“暖冰”的说法不正确的是
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰
12. 下列表示物质结构的化学用语或模型书写正确的是
下列表示物质结构的化学用语或模型书写正确的是
A.次氯酸的结构式:H-Cl-O B.丙烷分子的球棍模型示意图:
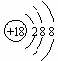
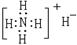
C.NH4H的电子式: D.S2-的结构示意图:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com