
题目列表(包括答案和解析)
1.2009年1月1日开始,我国将起征燃油税。较少汽油等成品油的使用是这次税费改革的
目的之一。下列说法中不正确的是 ( )
A.工业上将石油蒸馏得到汽油,发生了化学变化
B.汽车尾气中的碳氢化合物会加剧温室效应
C.汽车尾气的大量排放是形成光化学烟雾的重要原因
D.汽车尾气中“黑烟”会增加空气中固体颗粒的含量
30.(10分 )由Cu、Cu2O和CuO组成的混合物,加入100ml0.6mol/L的HNO3溶液恰好使混合物完全溶解,同时收集到224mlNO气体(标况)。回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学方程式:_____________________________________
(2)产物中硝酸铜的物质的量为__________mol。
(3)如原混合物中有0.01molCu,则其中Cu2O的物质的量为_______mol;CuO的物质的量为_______mol。
(4)如原混合物中Cu的物质的量为x,求x的取值范围_________________。
29.Ⅰ.合成氨工业具有重要意义,写出氨的两种重要用途
Ⅱ.实验室制备氨气,下列方法中适宜选用的是
①固态氯化铵加热分解 ②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热 ④固态氯化铵与氢氧化钙混合加热
Ⅲ为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)
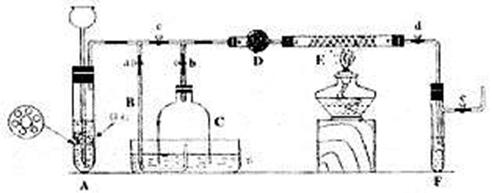
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e,在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生,在F出口处收集氢气并检验其纯度。②关闭弹簧夹c。取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞如图所示。氢气继续在瓶内燃烧,几分钟后火焰息灭。③用酒精灯加热反应管E继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 防止了实验装置中压强过大。此时再打开弹簧夹b的原因是_______________
C瓶内气体的成分是__________________________
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
28、茚是一种碳氢化合物,其结构为:
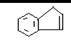 茚一种同分异构体A,A分子中含有一个苯环,且苯环上只有一个侧链,侧链中有一个碳碳不饱和键。A能发生如下变化:
茚一种同分异构体A,A分子中含有一个苯环,且苯环上只有一个侧链,侧链中有一个碳碳不饱和键。A能发生如下变化:

已知: 多个羟基连在同一个碳原子上不稳定,易自动失水:
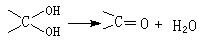
若B、C、D、E分子中均有一个苯环,根据变化关系图和已知条件,请回答
⑴ A的结构简式是 B的结构简式是
⑵ 写出下列反应的化学方程式
① E经缩聚生成高聚物
② F经加聚生成高聚物
⑶ E→F的有机反应类型是 反应。
27.(6分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
则原溶液中肯定存在的离子是_____________,肯定不存在的离子是________________
已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
26.W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为____________________________________。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______________。
(3)X的硝酸盐水溶液显__性,用离子方程式解释原因____________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为__。
(5)比较Y、Z最高价氧化物对应的水化物的酸性__________>___________(用分子式表示)
25.在由Fe、FeO、Fe2O3组成的混合物中加入100mL2mol/L盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,此时溶液中无Fe3+。下列判断正确的是( )
A、混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3
B、反应后所得溶液中的Fe2+和Cl-的物质的量之比为1:2
C、混合物中Fe、FeO、Fe2O3的物质的量之比无法确定,但Fe比Fe2O3的物质的量少
D、混合物中,Fe2O3的物质的量无法确定,但Fe一定比FeO的物质的量多
24.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的
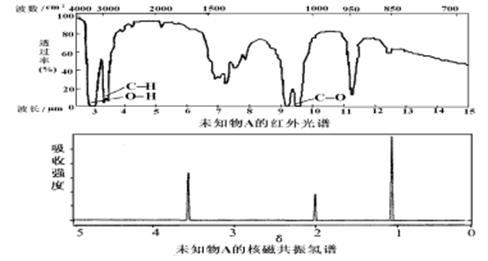
A.由红光外谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知该有机物的化学式
D.若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
23.已知气体的摩尔质量越小,扩散速度越快。右图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是( )
 A.甲是浓氨水,乙是浓硫酸
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
22.已知1-18号元素的离子aX2+、bY2-、cZ-、dW+都具有相同的电子层结构,下列关系正确的是
A. 离子半径X2+〉Y2- B.离子的还原性Y2-<Z-
C.氢化物的稳定性H2Y>HZ D.原子半径X<W
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com