
题目列表(包括答案和解析)
20.(5分)现将0.04mol·L-1HA的溶液和0.02 mol·L-1NaOH溶液等体积混合。
(1)若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”“=”
“>”)你得出的该结论依据是
。
(2)若HA为CH3COOH,该溶液显酸性,溶液中所有离子按浓度由大到小排列的顺序
是 。
19. (7分)设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。
(7分)设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。
 反应②Fe(s)+H2O (g) FeO(s)+H2 (g)的平衡常数为K2,在不同温度下K1、K2的值如
反应②Fe(s)+H2O (g) FeO(s)+H2 (g)的平衡常数为K2,在不同温度下K1、K2的值如
下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)平衡常数K1的表达式为 。
 (2)现有反应③CO2(g)+H2(g)
CO(g)+H2O(g),这是一个
(填“吸”
(2)现有反应③CO2(g)+H2(g)
CO(g)+H2O(g),这是一个
(填“吸”
或“放”)热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施
的有 。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量

 (3)若反应Fe(s)+CO2(g) CO(g)+H2O(g)在温度T1下进行;Fe(s)+H2O(g) FeO(s)
(3)若反应Fe(s)+CO2(g) CO(g)+H2O(g)在温度T1下进行;Fe(s)+H2O(g) FeO(s)
+H2 (g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则
两者的反应速率 (填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
18.(14分)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+。金属腐蚀造成很大的经济损
失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
一种钢铁防腐的方法是将钢铁放在冷的浓硝酸中浸泡。但是加热或在稀HNO3中,铁与
硝酸会不断反应。不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。
 (1)钢铁在冷的浓硝酸中浸泡能防腐的原因是:
(1)钢铁在冷的浓硝酸中浸泡能防腐的原因是:
。
(2)工业上一般不用冷浓硝酸进行铁表面处理,其
可能的原因是:
。
(3)由图示可知,密度等于1.35 g·mL-1的硝酸与铁
反应时,其还原产物主要是 ;足量的
铁与一定量的浓硝酸反应时,反应过程中可能的
气体产物有 ;还原产物中NH4+的
物质的量分数随 而增大;请用
一句话概括该图反映出的基本结论:
。
(4)m mol 铁与极大量的密度为1.35 g·mL-1的硝酸溶液完全反应放出n L气体(体积
在标准状况下测定),此时溶液中Fe元素的存在方式是 , n 的值最接
近 (填字母编号)。
A.22.4m B.33.6m C.44.8m D.67.2m
(5)除了上述处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬、镍等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
17. (12分)现有下列短周期元素性质的数据:
(12分)现有下列短周期元素性质的数据:
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.73 |
1.02 |
1.34 |
1.06 |
0.99 |
1.54 |
0.75 |
1.18 |
|
最高或最低化合价 |
|
+6 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
-2 |
|
-3 |
-1 |
|
-3 |
|
试回答下列问题:
(1)元素③在周期表中的位置是 ;元素④与元素⑦相比较,气态氰化物较稳定
的是 (填化学式);
(2)元素①与元素⑥按照原子个数比为1:1形成的化合物中化学键的类型为
。
(3)Y和Z均由元素①组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
Ⅰ.Y与Z的关系是(选填字母) :
a.同位素 b.同素异形体 c.同系物 d.同分异构体
Ⅱ.将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区分二者的实验方法
;
(4)元素⑤的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶
液,并放出QkJ的热量。写出该反应的热化学方程式 ;
(5)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应式:
。
16. 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
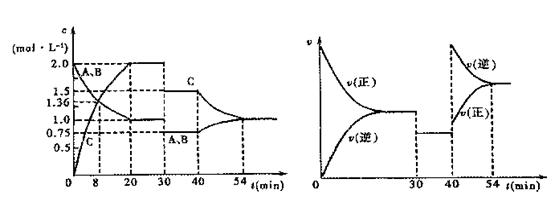 A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、
反应速率随时间变化的关系如下图所示。下列说法中正确的是 ( )
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol·L-1·min-1
C.反应方程式中的x=1,正反应为吸热反应
D.该反应20min~30min的平均常数比30min~40min的平衡常数大
第Ⅱ卷 (非选择题 共52分)
15.氢化亚铁(CuH)是一种难容物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时
反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,
以下有关的推断中错误的是 ( )
A.“另一种反应物”一定具有还原性 B.CuH既可做氧化剂也可做还原剂
C.CuH+Cl2===CuCl+HCl(燃烧) D.CuH+HCl===CuCl+H2↑(常温)
1.3×10-35mol·L-1
C.因为H2SO4是强酸,故Cu2++H2S=CuS↓+2H+不能发生
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
14.已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp=1.3×10-36
mol2·L-2;ZnS:Ksp=1.6×10-24mol2·L-2。下列说法正确的是 ( )
A.同温度下,CuS的溶解度大于ZnS的溶解度
B.将足量CuSO4溶解在0.1mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为
13.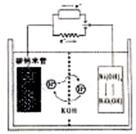 一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol·L-1KOH溶液,
一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol·L-1KOH溶液,
下列说法不正确的是 ( )
A.储存H2的碳纳米管放电时为负极,充电时为阴极
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为
NiO(OH)+H2O+e-===Ni(OH) 2+OH-
D.放电时,电池反应为2H2+O2===2H2O
12.下列粒子方程式正确的是 ( )
A.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
B.碳酸氢铵和氢氧化钠的反应:NH4+、+OH-===NH3↑+H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2===3Fe3++2Br2+6Cl-
D.少量SO2通入Ca(ClO) 2溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com