
题目列表(包括答案和解析)
6.液态锂离子电池是指Li+嵌入化合物为正负电极的二次电池。正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6( 0 < x ≤ 1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液。下列有关说法不正确的是 ( )
A.将LiCoO2改写为氧化物的形式为Li2O·Co2O3
B.该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性
C.Li是3号元素,是最轻的金属之一,这类电池质能比高
 D.在电池放电时,Li+在两个电极之间往返嵌入和脱嵌。该电池的充放电反应方程式为:LiCoO2+6C Li1-xCoO2+LixC6
D.在电池放电时,Li+在两个电极之间往返嵌入和脱嵌。该电池的充放电反应方程式为:LiCoO2+6C Li1-xCoO2+LixC6
5.下列对实验现象的解释与结论正确的是 ( )
|
编号 |
实验操作 |
实验现象 |
解释与结论 |
|
A |
向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液 |
有白色沉淀产生 |
蛋白质发生了变性 |
|
B |
向某溶液中加入BaCl2 溶液 |
有白色沉淀产生 |
生成难溶于水的BaSO4,该溶液中一定含有SO42- |
|
C |
向甲苯中滴入少量浓溴水,振荡,静置 |
溶液分层,上层呈橙红色,下层几乎无色 |
甲苯和溴水发生取代反应,使溴水褪色 |
|
D |
向蔗糖中加入浓硫酸 |
变黑,放热,体积膨胀,放出刺激性气体 |
浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
4.有M、N两溶液,各含有下列14种离子中的7种,Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是: ( )
A.OH-、S2-、CO32- B.MnO4-、SO42-、NO3-
C.Cl-、NO3-、SO42- D.AlO2-、MnO4-、SO42-
3.下列操作或仪器的选用正确的 ( )
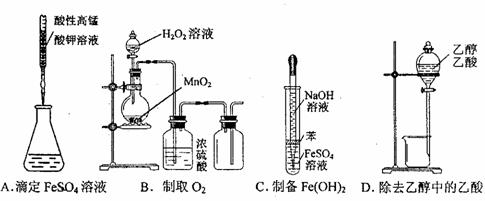
2.下列有关化学用语或名称,表达正确的是 ( )
A.COCl2分子的结构式: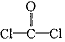 B.二氧化碳分子的比例模型:
B.二氧化碳分子的比例模型:
C.氯仿的电子式: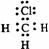 D.
D.
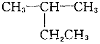 的名称:2-乙基丙烷
的名称:2-乙基丙烷
1.2008年6月1日起,所有超市、商场、集贸市场等商品零售场所将实行塑料购物袋有偿使用。下列说法正确的是 ( )
A.控制塑料购物袋的使用主要是为了节约成本
B.使用可降解塑料袋有利于减少“白色污染”
C.聚氯乙烯塑料袋可用来长时间存放食品
D.塑料购物袋具有热固性,不能回收利用
19.(7分)短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如图17所示转化(部分产物已略去):

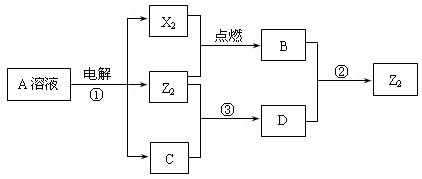
(1)Y在周期表的位置是______________;Z2的电子式是____________________。
(2)反应①的化学方程式是________________________________________________。
(3)D溶液呈碱性的原因是(用离子方程式表示)______________________________;
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图18所示(夹持固定装置的仪器已略去)。

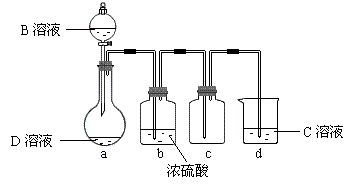

I.写出反应②的离子方程式_____________________ ___。
II.上述实验装置不够完善,改进方法是 。
(4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是
 3Z2+6C
5A+YZO3+3H2O ,
3Z2+6C
5A+YZO3+3H2O ,
3mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是________________。
18.(17分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化
硫的实验装置。
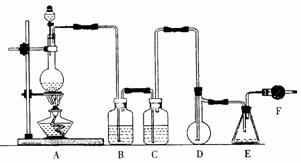
试回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)装置B应盛放的药品是 ,C中是 。
(3)实验开始前先在D中放一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50-59℃.最好采用 方式加热。如何防止E中液体挥发 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
(6二氯化硫电子式为 ,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
(7)在配制一定物质的量浓度的盐酸溶液时,下列操作所配溶液浓度偏低的是_____:
A配制溶液时,容量瓶中有少量水。
B使用容量瓶配制溶液时,俯视观察溶液凹液面与容量瓶刻度线相切
C配制溶液的过程中,容量瓶未塞好,洒出一些溶液。
D发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线
17.(15分)发射“神舟”飞船的火箭用肼(N2H4)作燃料,N2H4与NH3有相似的化学性质。
(1)写出肼与盐酸反应的离子方程式 ______ 。
(2)用拉席希法制备肼,是将NaClO和NH3按物质的量之比1:2反应生成肼,试写出该反应的化学方程式_______________________________________________。该反应中 是氧化产物。
(3) 120℃、1.0×105Pa下,3mlNxHy 在4ml纯氧气中完全燃烧生成N2和H2O,恢复到原状况,体积变为10ml,己知反应后有1mlO2过量。则NxHy的化学式为_____________,推出该化学式用到了________________________定律和____________________定律。
16.(16分)5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:___________________________________
(2)过碳酸钠是一种有多用途的新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是_________
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中氧化剂与还原剂的物质的量之比为_
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com