
题目列表(包括答案和解析)
25.(6分)已知由硝酸银和硝酸铜组成的100mL混合溶液中,c(NO3-)=2mol/L。现往其中加入一定量的铝粉,充分反应后过滤,将滤纸上的沉淀干燥后称重为12.4g。将此沉淀加入稀盐酸中无气体产生。滤液中滴入NaCl溶液无现象。后加入过量的稀NaOH溶液得到沉淀。过滤、加热、冷却、称重为2g。
求:(1)原混合溶液中硝酸银和硝酸铜的物质的量之比。
24.(6分)在稀硫酸溶液中,4.48g Cu2S和CuS的混合物与100mL 0.75mol·L-1的MnO4-反应生成了SO42-、Cu2+和Mn2+。剩余的MnO4-恰好与35.0mL 1.00mol·L-1 FeSO4溶液反应。
(1)配平下列反应化学方程式:
____Cu2S+____ MnO4-+____H+===____ Cu2++____SO42-+____ Mn2++____H2O
(2)试计算原始混合物中Cu2S的质量分数。
24.(6分)将4 mol SO3气体和4 mol NO置于2 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g)  2SO2+O2、2NO+O2
2SO2+O2、2NO+O2  2NO2
2NO2
⑴当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为 。
⑵当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
⑶在其它条件不变的情况下,若改为起始时在1 L容器中充入2 molNO2和2 molSO2,则上述两反应达到平衡时,c (SO2)平= mol/L。
23.(10分)以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
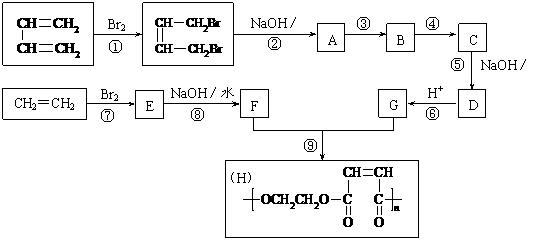
请按要求填空:
⑴写出下列反应的反应类型:
反应①________________,反应⑤________________,反应⑧________________。
⑵反应②的化学方程式是______________________________________________。
⑶反应③、④中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是_________________________________________________,物质C的结 构简式是_______________________。
22.(10分) A是一种含碳、氢、氧三种元素的有机化合物,已知:A相对分子质量为144,其中碳的质量分数为50%。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B和甲醇。B中碳、氢、氧原子个数比为1:1:1,分子中没有支链,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有 (选填编号)
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子所含官能团的名称是 、 。
(3)与B具有相同官能团的同分异构体的结构简式是 。
(4)由B制取A的化学方程式是: 。
21.(12分)A-N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
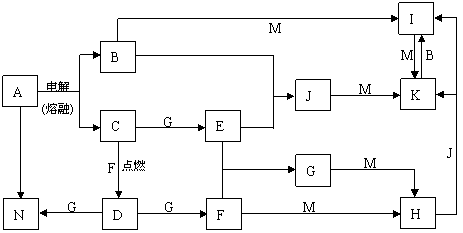
回答下列问题:
⑴H的化学式为__________,D的电子式为__________。
⑵工业上用A制取N的化学反应方程式为____________________________________。
⑶D与G反应的离子方程式为_______________________________________。
⑷I的浓溶液滴入沸水中反应的离子方程式为___________________________________。
⑸G与M反应的化学方程式为 。在一定条件下该反应也可以向相反的方向进行,请判断该反应与上述转化是否矛盾并说明理由________________________________________________________________________
__________________________________________________。
20.(8分) A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心。
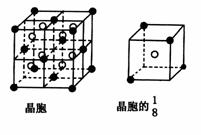 根据以上信息,回答下列问题:
根据以上信息,回答下列问题:
(1)比较A和D的氢化物,后者的沸点较低,其原因是 ;
(2) B的离子结构示意图为 。元素C在元素周期表中的位置是 ;
(3) A和E形成的化合物的电子式是 。
19.(14分)Ⅰ.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可采用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式 。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:① 溴水将乙醛氧化为乙酸; ② 溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
 Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1min后鼓入空气。请填写下列空白:
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1min后鼓入空气。请填写下列空白:
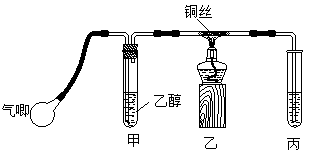
⑴乙醇发生催化氧化的化学反应方程式为____________________________________。
⑵实验时,常常将甲装置浸在70℃-80℃的水浴中,目的是____________________;由于装置设计上的缺陷,实验进行时可能会 。
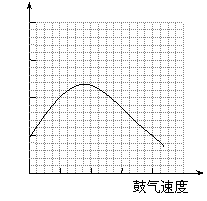
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因: ;你认为该实验中“鼓气速度”这一变量可用 来计量。
18.(8分)为防止碘缺乏病,,通常在食盐中加入KIO3。
⑴用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是____________________________________,若要确认食盐中还含有K+,方法是____ __________________________________________________________________________。
⑵工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作_________(填“阳极”或“阴极”),石墨电极上的电极反应式是____________________________,电解过程中铁电极附近溶液pH__________(填“变大”、“变小”或“不变”)。
17.(6分)实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验,请完成下列填空
取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2-3次,记录数据如下:
|
实验 编号 |
NaOH溶液的浓 度(mol·L-1) |
滴定完成时滴入NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
|
1 |
0.10 |
22.62 |
20.00 |
|
2 |
0.10 |
22.72 |
20.00 |
|
3 |
0.10 |
23.80 |
20.00 |
①滴定达到终点的标志是__________________________________________________。
②根据上述数据,可计算出该盐酸的物质的量浓度约为_______(保留两位有效数字)。
 ③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。(多选扣分)A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com