
题目列表(包括答案和解析)
3. 实验室有一瓶未开封的浓盐酸,部分标签如右图所示。这瓶浓盐酸中溶液的质量为
g.若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是
mL,水的体积是
mL。
实验室有一瓶未开封的浓盐酸,部分标签如右图所示。这瓶浓盐酸中溶液的质量为
g.若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是
mL,水的体积是
mL。
2. 向盛有12.60g碳酸氢钠固体的烧杯中,加入100.5g硫酸溶液恰好反应。反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示。烧杯连同药品的起始质量为200.0g。反应的化学方程式为:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
回答下列问题:
(1) 当碳酸氢钠与硫酸溶液恰好完全反应时,
所需的时间约为 。
(2) 当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为 。
(3) 反应后,所得硫酸钠溶液的溶质质量分数为多少?
1. 在t℃时,有94g饱和硝酸钾溶液,当蒸发掉25g水,再冷却到t℃时,剩余溶液的质量为41.5g,求:
(1) 硝酸钾在t℃时的溶解度;(2) 剩余溶液中溶质的质量分数。
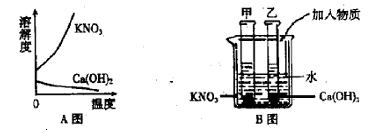
20. A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中固体减少,乙试管中的固体增加,则加入的物质可能是 或 。
19. 为了配制50g 5%的氯化钠溶液,需进行如下操作:① 计算;② 用托盘天平称量
_________g 氯化钠;③ 用__________(填“10mL”或“50mL”)量筒量取______mL水;④ 将两者置于烧杯中,用玻璃棒搅拌。
18. 下面的表格中列出了氯化铵在不同温度下的溶解度:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
溶解度/g |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
60.2 |
65.6 |
(1)从表中可得到的一条信息是___________________________________。
(2)在20℃时,向100g水中加入50g氯化铵,形成氯化铵的______(填“饱和”或“不饱和“)溶液,将其温度升高至60℃时,溶液的质量为________g,该溶液中溶质与溶剂的质量比为______________。
17. 氯化钠和硝酸钾两种物质的溶解度随温度(0-100℃)的变化见下表:
|
|
0℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
|
NaCl(g) |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
KNO3(g) |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
请分析表格中的数据,回答下列问题:
①若两物质的溶解度相等,此时所对应的温度范围在 之间;
②20℃时,氯化钠饱和溶液的质量分数 硝酸钾饱和溶液的质量分数(填“>”、“<”或“=”);
③某同学欲从含有少量氯化钠的硝酸钾中分离出硝酸钾,他应采取的方法是
。
16.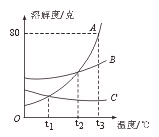 右图是A、B、C三种物质的溶解度随温度变化的曲线图.根据图回答:(1)S表示物质的溶解度,在________________℃时SA=SB>SC;
右图是A、B、C三种物质的溶解度随温度变化的曲线图.根据图回答:(1)S表示物质的溶解度,在________________℃时SA=SB>SC;
(2)随着温度的升高,A、B、C三种物质的饱和溶液中有溶质从溶液中析出的是_________________。
(3)要将B物质从它的饱和溶液中析出,应采用的方法是_______________(填冷却或蒸发)
(4)t3℃时,90 gA物质的饱和溶液中,含有A物质_________________g。
15.若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则:
A.溶液的质量一定变小 B.溶液中溶质量分数一定变大
C.溶液的质量一定变大 D.溶液中溶质的质量分数可能不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com