
题目列表(包括答案和解析)
7.下列实验现象描述正确的是( )
A.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾
B.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫色
C.往溴水中加入碘化钠溶液,溴水变为无色
D.红热的铜丝在氯气中燃烧,产生棕黄色的烟
6.体积为V mL,密度为ρ g·cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol·L-1,质量分数为w%,下列表示式正确的是( )
A. c=1000Vρ B. m=Vρ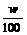 C.w%=
C.w%=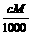 % D.c=
% D.c=
5.下列关系正确的是( )
A.还原性: Na>K B.溶解性:NaHCO3 > Na2CO3
C.热稳定性: Na2CO3>NaHCO3 D. 熔点 :Na<K
4.下列各项中的两个量,其比值一定为2:1的是( )
A.在Na2O2晶体中阳离子与阴离子的物质的量之比
B.22.4LCO2与22.4L CO所含氧原子数目之比
C.1000mL容量瓶的容积与500mL容量瓶的容积之比
D.液面均在“0”刻度时,50ml碱式滴定管和25ml碱式滴定管所盛溶液的体积之比
3.下列条件下,两瓶气体所含分子数一定相等的是( )
A.同体积、同密度的C2H4和C3H6 B.同温度、同体积的H2和N2
C.同质量、不同密度的N2和CO D.同压强、同体积的N2O和CO2
2.下列物质的保存方法不正确的是( ) A.新制氯水应用棕色瓶密封保存 B.盛液溴的试剂瓶常加少量水 C.少量的金属钠应保存在煤油中 D.固态碘放在棕色细口瓶中
1.随着科学技术的不断进步,研究物质的手段和途径越来越多,N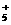 、H3、O4、C60等已被发现。下列有关说法中,正确的是( )
、H3、O4、C60等已被发现。下列有关说法中,正确的是( )
A.N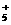 离子中含有36个电子 B.O2和O4属于同位素
离子中含有36个电子 B.O2和O4属于同位素
C.C60是原子晶体 D.H2和H3属于同素异形体
37.Ⅰ(5分)将一定质量的铁粉加入到装有100 mL某浓度的稀硝酸溶液中充分反应。
⑴容器中剩有m g的铁粉,收集到NO气体448 mL(标准状况下)。
① 所得溶液中的溶质的化学式是 ;
② 原硝酸溶液的物质的量浓度为: mol/L
⑵向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ;
②m–n的值为 g 。
 Ⅱ:(4分)向某密闭容器中加人 0.3
molA、0.1 molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间的变化如下图中甲图所示。附图中乙图为 t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知t3 ~t4阶段为使用催化剂[已知 t0~ t1阶段 c ( B)未画出]。
Ⅱ:(4分)向某密闭容器中加人 0.3
molA、0.1 molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间的变化如下图中甲图所示。附图中乙图为 t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知t3 ~t4阶段为使用催化剂[已知 t0~ t1阶段 c ( B)未画出]。
(1)若 t1= 15 s ,则t0~ t1阶段以C 浓度变化表示的反应速率为 ;
(2)t4 ~t5阶段改变的条件为 ,B的起始物质的量为 ;
(3)t5 ~t6阶段容器内A的物质的量共减少0. 03 mol ,而此过程中容器与外界的热交换总量为akJ ,写出该反应的热化学方程式 。
36.(11分)人体呼出气体中含有N2、O2、CO2、水蒸气等多种成分。某课外学习小组利
用下图装置测定N2、O2、CO2、的百分含量(忽略水蒸气等微量成分)。其中B是带刻度
的量气装置。
试验步骤:
 ①先检验装置的气密性。再向装置中装入药品(如图所示),其中C瓶溶液上方为100mL
①先检验装置的气密性。再向装置中装入药品(如图所示),其中C瓶溶液上方为100mL
已除尽CO2的空气(N2和O2的体积比为4 :1)。
②打开止水夹b、c、d,关闭止水夹e,向B瓶中吹气后关闭d,并冷却到室温,收集到
V1mL气体。
③关闭b,打开止水夹a、c、e、f,用打气筒向A瓶中缓缓充气,直到B中气体刚好全
部排出,此时量筒中液面读数为V2mL。
④关闭e、f,降低燃烧匙的高度,用电火花引燃红磷。
⑤等C瓶冷却到室温,打开f1最终量筒液面读数为V3mL。
回答下列问题:
(1)A、B中装饱和NaHCO3而不能装饱和Na2CO3溶液的原因是 。
(2)C装置中红磷要过量的目的是 。
(3)反应结束后,C瓶溶液中含有溶质的化学式为
(4)利用上述数据计算人体呼出气体中氧气所占体积百分数为
CO2所占体积百分数为
(5)步骤⑤中C瓶还未冷却到室温就打开止水夹读数,这样会使所测氧气体积分数
(填“偏大”或“偏小”)。
(6)严格按①-⑤进行试验后测得数据仍有一定误差,可能的原因是(答出一点即可)
35.(8分)原子序数依次增大的A、B、C、D、E、F、G七种短周期主族元素
① B元素的原子最外层电子数是次外层电子数的两倍,
② C的最高价氧化物的水化物和氢化物反应生成盐
③ D和E可以形成1:1和1:2的两种常见化合物。
④ A与C元素原子的电子层数相差1,且与E是同主族元素
⑤ 原子半径由大到小顺序是E>F>G>B>C>D>A
⑥ F是同周期中离子半径最小的元素,G是同周期中原子半径最小的元素
回答: (1)由B、D、E三元素组成的无机盐水溶液呈碱性,其原因是(用离子方程式表示) 。
(2)A的单质和D的单质可以设计为新型燃料电池,电解质为KOH溶液,则A的单质在该燃料电池中发生的电极反应式为 。
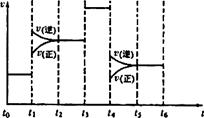 (3)当反应3A2(g)+C2(g)
(3)当反应3A2(g)+C2(g) 2CA3(g)达到平衡时,不断改变反应条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。
2CA3(g)达到平衡时,不断改变反应条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。
(4)D和E能形成1:1和1:2的两种常见化合物X和Y :
写出Y与水反应的离子方程式: 。若将X、Y分别溶于等量足量的水中,形成浓度相同的溶液,需X、Y的物质的量的关系为: n(X) n(Y)(填“<”“>”或“=”)
(5) C、D、E、F、G的简单离子的半径由大到小的顺序是(用元素的离子符号表示)
(6) F的最高价氧化物对应水化物的电离方程式为
(7)用离子方程式说明C与A形成的化合物结合H+能力强于D与A形成的化合物:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com