
题目列表(包括答案和解析)
2. 将铜、锌两种金属的混合物20g,放入100g稀硫酸中恰好完全反应,共放出0.2g氢气。求:(1)原混合物中铜的质量分数。
(2)反应后溶液中溶质的质量分数。
1.小明同学对某炼铁厂进购的赤铁矿样品进行分析。取10.0g的样品,完全反应后,共用去稀盐酸103.0g,过滤后得到2.5g滤渣,(假设杂质既不溶于酸,也不溶于水;不考虑实验中的损耗)。求:
(1) 赤铁矿样品中Fe2 O 3的质量分数为多少?
(2) 稀盐酸中溶质的质量分数为多少?
9. 实验室里某小组正在探究一个问题。根据设计方案,小英向试管中加入2mL氢氧化钠溶液,滴入几滴酚酞溶液,溶液显红色。然后她又用滴管连续滴入一定量的稀硫酸,溶液由红色变为无色。
(1)他们探究的问题是____________(填Ⅰ或Ⅱ)
Ⅰ.酚酞溶液遇酸、碱溶液能显示不同颜色吗?
Ⅱ.酸和碱溶液能发生反应吗?
(2)大家对小英得到的无色溶液继续探究。小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是________________________。同学们根据以下两种方案进行实验后,一致认为小亮的观点是正确的。请你补填下表的空缺。
|
实验操作 |
实验现象 |
实验结论 |
|
方案一:取少许反应后的 溶液置于试管中,向其中加入________ |
|
小亮的观点正确 |
|
方案二:取少许反应后的 溶液置于试管中,向其中加入________ |
|
(3)请你和全组同学一起分析以下问题。
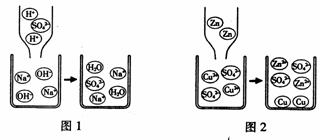
①稀硫酸和氢氧化钠溶液发生反应的微观过程如图1所示。从粒子的角度具体分析该反应能发生的原因是_____________________________________。
②锌和硫酸铜溶液发生反应的微观过程如图2所示。从粒子的角度具体分析该变化是化学变化的原因是____________________________________。
③通过以上分析,揭示出化学反应的微观本质是___________________________。
8. 小婧同学做硫在氧气中燃烧的实验前,预先在集气瓶底装有少量水。实验过程中她联想到老师介绍过二氧化硫排放到空气中会形成酸雨,于是想了解燃烧后集气瓶底部残留的“水”是否也呈酸性。她取“水”多次测其pH,发现其pH始终小于7并逐渐减小,直至稳定在pH=4,证明集气瓶底残留液呈酸性。随后小婧想进一步了解该残留液是否具有 酸的通性,请你与她一起探究:
[提出问题]残留液还能与什么物质反应呢?
[猜想] ;
[设计方案]请你设计实验来验证你的猜想:
|
实验方法 |
可能观察到的现象 |
结论 |
|
|
|
|
7. 某同学想探究酸碱中和反应是放热反应。进行下列实验操作:取溶质质量分数为20%的稀硫酸30mL,用温度计测出其温度为13℃。然后向其中加入5.6gNaOH固体,恰好完全反应。再用温度计测出温度为22℃。由此,该同学得出NaOH与稀硫酸发生的中和反应是放热反应的结论。请回答下列问题:
(1) 该同学所得的结论的依据是否科学?_____________(选填“科学”或“不科学”)
理由是 。
(2)根据本实验的目的,请你改进他的实验操作 。
6. 今年6月1日,江苏省环保厅公布了2005年全省环境质量公报。公报显示,无锡市空气质量较差,为中污染级,其中二氧化硫未能达到国家环境空气质量二级标准。某研究性学习小组的同学认为“保护环境,人人有责”,他们在课外活动时对“二氧化硫能否与水反应生成酸”进行了实验探究。请你参与他们的探究活动,并回答有关问题。
[查资料]常温下二氧化硫是一种无色气体,易溶于水。
[假 设]二氧化硫能与水反应生成酸。
[设计实验]
(1)小雨同学将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色的变化。他认为,若紫色石蕊试液变 ① 色,则证明假设成立。
(2)小涛同学认为小雨同学的实验方案不严密。小涛同学用紫色石蕊试液将白色滤纸染成紫色,干燥后做成三朵紫色的小花,然后按下列图示进行实验,在(I)、(Ⅱ)、(Ⅲ)中分
别观察到变色和不变色的两种现象。

小涛同学认为,若 ② (填序号)中的紫色小花变色,则证明假设成立。
[交流与反思]小明同学对小涛同学的实验方案提出了质疑,他认为上述实验还不足以证明“二氧化硫和水反应生成了酸”,其理由是 ③ 。三位同学讨论后补充了一个实验,使探究活动获得了成功,你认为这个实验应该是 ④ (简述实验步骤和现象)。
[结 论]通过上述实验得出:二氧化硫能与水反应生成酸。
5. 铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域。铝亦有其特殊的性质,试根据以下信息填空或简答。
(1)按金属的活动性顺序,铝比锌 。但是将铝片和锌粒分别投入稀硫酸中,铝片表面产生的气泡却比锌粒少而慢。为了探究铝与酸反应的规律,小强将已被砂纸打磨过的相同大小的6枚铝片,分别放人下表所示溶液中进行实验。
|
溶液 |
现象 |
溶液 |
现象 |
溶液 |
现象 |
|
①稀硫酸 |
一 |
③稀硫酸(加入少量Na2SO4固体) |
一 |
⑤盐酸 (1 :4) |
+ |
|
②稀硫酸 (加热) |
+ |
④稀硫酸(加入少量NaCl固体) |
+ |
⑥盐酸 (37%) |
++ |
注:“一”表示铝表面产生气泡很小且慢;“+”表示铝表面产生气泡较大且快。
“1 :4”表示用1体积的37%浓盐酸与4体积的水混合所得溶液。
根据上述表格内容,你认为铝与酸反应产生氢气的速率,除了跟酸溶液中氢离子浓度有关外,还可能受到 、 、 等多种因素的影响。
(2)小芳将长条状铝片的一端放在酒精灯火焰上灼烧片刻,轻轻摇动铝条,受热一端会左右摇晃,却不像蜡烛那样滴落。为究其原因,小芳查阅资料得知:铝的熔、沸点分别是660℃、2460℃;氧化铝的熔、沸点分别为2054℃、2980℃。
请解释上述实验现象:
。
4. 下图为某同学探究铁、铜、银三种金属活动性顺序的一组实验


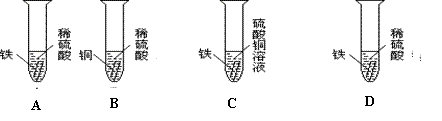
(1)上述实验中,有气泡产生的是(填写装置序号)_____ ___,请写出这一反应的化学方程式 。
(2)我国古代“湿法冶铜”就是利用了C中的反应原理,请写出该反应的化学方程式 。
(3)通过上述实验,还不能证明铁、铜、银三种金属的金属活动性顺序,请你在此基础上补充一个实验帮助这位同学达到实验目的。
|
实验步骤 |
现象 |
结论 |
|
|
|
|
3. 化学课外活动小组的同学们通过查阅资料得知:废弃的定影液中含有一定量的AgNO3。他们从摄影店收集到一些废弃的定影液,准备将其中的银以单质的形式全部回收。于是,他们进行了如下的实验活动:
[设计方案]①加入比银活动性强的金属单质;②除去金属混合物中的杂质。
[小组讨论]①选择加入的金属 甲同学认为:向定影液中加入过量的铜粉,则得到银和铜的金属混合物;乙同学认为:向定影液中加入过量的铁粉,则得到银和铁的金属混合物。
你认为 (填“甲”或“乙”)同学的方案更合理,原因是 ;
②除去银粉中混有的金属 向上述所得的金属混合物中加入的试剂是 ,反应的化学方程式为 。
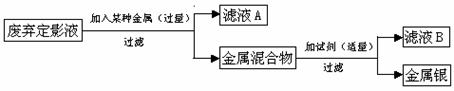 [进行实验]其实验过程图示如下
[进行实验]其实验过程图示如下
在过滤操作中必须要用到的玻璃仪器是 ,滤液A中溶质的化学式是 ;
[产品验证]请你设计一种简单方法检验得到的银粉中是否含有铁粉: 。
2. 食品包装盒中常放一小袋粉末状物质,该物质对食品同时具有防潮和防氧化作用。某同学从超市购买的食品包装盒中取出装有粉末状物质的小袋,撕开发现袋里有板结的红褐色固体,就近嗅到铁锈味。
(1) 试推测粉末状物质可能是 ;其作用原理是 。
(2) 查阅资料得知:铁锈中铁元素呈正三价,Fe3+ 和硫氰化钾溶液反应后能生成血红色的化合物。
(3) 设计一个实验,证明你的猜想。(药品和仪器自选,实验方案可用绘图表示或文字叙述)
|
实验方案 |
实验现象 |
结论或解释 |
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com