
题目列表(包括答案和解析)
19. 用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是
A.相同状况下两电极上产生的气体体积之比为2∶1
B.两电极上产生的气体质量之比为8∶1
C.相同状况下两电极上产生的气体体积之比为4∶1
D.若两电极上产生的气体质量比为16∶3,则D2O与H2O的物质的量之比为2∶1
18.燃料电池是燃料(如H2、CO、CH4等)跟氧气或空气起反应,将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法中正确的是
A.负极反应:O2+2H2O+4e-=4OH-
B.负极反应:CH4+10OH--8e-=CO32-+7H2O
C.随着放电的进行,溶液的pH不变
D.放电时溶液中的阴离子向正极移动
17.某羧酸的衍生物A,其分子式为C6H12O2,实验表明A和NaOH溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜作催化剂和加热条件下氧化为E,其中D、E都不能发生银镜反应,由此判断A的可能结构简式有
A.2种 B.3种 C.4 种 D.6种
16.右图所示的反应均是在高温或引燃后进行。选项中的物质表示A和B,不合理的是( )
A.CO2、Mg
 B.MgO、Al
B.MgO、Al
C.Fe3O4、Al
D.CuO、H2
15.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应:
Fe2O3+3Na2O2  2Na2FeO4+Na2O。下列说法正确的是( )
2Na2FeO4+Na2O。下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
C.3mol Na2O2发生反应,有12mol电子转移
D.Na2FeO4既是氧化产物又是还原产物
14.下列说法正确的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
④硫酸厂厂址的选择应靠近原料产地
⑤碳酸氢根离子的电离方程式: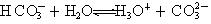
⑥从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
⑦因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
⑧NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着
6个Cs+
A.①②④⑦ B.①⑤⑥ C.②③④⑧ D.②⑤
13.将4molA气体和2molB气体在2L的密闭容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 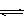 2C(g);△H<0 4s(秒)后反应达到平衡状态,此时测得C的
2C(g);△H<0 4s(秒)后反应达到平衡状态,此时测得C的
浓度为0.6mol·L-1,下列说法中正确的是 ( )
A.反应过程中,当A、B、C的物质的量浓度之比为2∶1∶2时,反应即达到平衡状态
B.4s内用物质B表示的反应速率为0.075mol·L-1·min-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将减小
12.五颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是
①新制氯水久置后→浅黄绿色消失; ②淀粉溶液遇单质碘→蓝色;
③钠在空气中放置一段时间→黄色; ④热的黑色氧化铜遇乙醇→红色
⑤鸡蛋白溶液遇浓硝酸→黄色; ⑥苯酚在空气中氧化→粉红色
A.①②③④⑤ B.②③④⑤⑥ C.①②④⑤⑥ D.①③④⑤⑥
11.M和N两溶液分别含有下列十二种离子中的五种和七种离子:K+、Na+、H+、NH4+、Fe3+、Al3+、Cl-、OH-、NO3-、S2-、CO32-、SO42-。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是( )
A.OH-、CO32-、SO42- B.S2-、Cl-、SO42-
C.CO32-、NO3-、S2- D.Cl-、SO42-、NO3-
10.下列说法不正确的是( )
A.100℃时,纯水中c(H+)=1×10-6mol·L-1,pH小于7,此时纯水显酸性
B.pH=12的烧碱和氢氧化钡溶液,二者物质的量浓度之比为2∶1
C.pH=3的盐酸与pH=5的硫酸等体积混合,pH=3.3
D.0.1mol·L-1CH3COOH溶液中;c(CH3COOH)>c(CH3COO-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com