
题目列表(包括答案和解析)
16.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液。由于浓度不同而能发生不同氧化还原反应的是
A.①③ B.③④ C.①② D.①③④
15.下列叙述中正确的是
① CO2是由极性键构成的非极性分子
② 由于氢键的作用,水的稳定性强于硫化氢
③ 离子晶体一定含有离子键,分子晶体中一定含有共价键
④ 在晶体中只要有阴离子就一定有阳离子
⑤ 原子晶体的熔点一定比金属晶体的高,分子晶体的熔点一定比金属晶体的低
⑥ 二氧化硅和氯化钠熔化时所克服的化学键类型不同
A.①④⑤ B.②④⑤ C.①④⑥ D.①③⑥
14.如图所示元素周期表前四周期一部分,关于元素X、Y、Z、W的叙述正确的是
 ① X、Y的最高价氧化物的水化物的酸性为Y<X
① X、Y的最高价氧化物的水化物的酸性为Y<X
② Y、Z的气态氢化物的稳定性Y<Z
③ W的单质常温下呈液态,可与铁粉反应
④ W的原子序数比Z大9
⑤ W所在的周期中包含有32种元素
⑥ 标准状况下,22.4LR单质所含的原子数为2NA
A.只有③⑥ B.①②⑤ C.①②③ D.①②③④
13.在溶液中加入足量的Na2O2后仍能大量共存的离子组是
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
12.下列离子方程中错误的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO2-4=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH+4+HCO-3+2OH-=NH3·H2O+CO2-3+H2O
C.苯酚钠溶液中通入过量CO2:

D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+2Cl-
11.右图为氯化钠的晶体结构模型,下列说法不正确的是
A.NaCl晶体中Na+与Cl-的个数比为1︰1
B.每个Na+周围距离最近的Cl-数为6
C.每个Na+周围距离最近的Na+数为8
D.和Na+距离相等且最近的Cl-构成的多面体是正八面体
10.现有带活塞的密闭容器A和B,10℃时容器A装入碘化氢气体、容器B装入二氧化氮气体,使其体积相等。当温度不变时,缓缓压缩两容器,使两容器的压强均为原来的4倍,此时两容器内气体的体积关系正确的是
A.A>B B.A<B C.A=B D.无法判断
9.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g),已知:
N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol;
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是
A.2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g);△H=–542.7 kJ/mol
B.2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g);△H=–1059.3 kJ/mol
C.N2H4(g) + 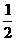 N2O4(g)=
N2O4(g)= N2(g)+ 2H2O(g);△H=–1076.7 kJ/mol
N2(g)+ 2H2O(g);△H=–1076.7 kJ/mol
D.2N2H4(g) + N2O4(g)= 3N2(g)+ 4H2O(g);△H= –1076.7 kJ/mol
8.已知X和Y为同一周期元素。若X为IIA族元素,Y为IIIA族元素,它们的原子序数分别为m和n,则下列关系式错误的是
A.n=m+1 B.n=m+10 C.n=m+11 D.n=m+25
7.设NA为阿伏加德罗常数,下列说法正确的是
① 2L 1mol/L NH4Cl溶液含NH+4和Cl-均为2NA
② 在常温常压下,22g二氧化碳含有共用电子对总数为2NA
③ 0.1 mol OH-的质子数与0.1mol H2O的电子数均为NA
④ 在标准状况下,11.2L二氯甲烷含有的分子数为0.5NA
⑤ 含1mol碳原子的金刚石中,C-C共价键为2NA
⑥ 常温常压下,17g甲基(14-CH3)所含的中子数为9NA
A.①② B.③④ C.②⑤ D.⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com