
题目列表(包括答案和解析)
20.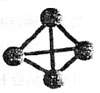 对于氮元素形成的单质,除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等。其中高聚氮是在高压下通过氮气的聚合生成的,晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构:N4分子结构如右图所示。已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以下信息和数据,下列说法正确的是
对于氮元素形成的单质,除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等。其中高聚氮是在高压下通过氮气的聚合生成的,晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构:N4分子结构如右图所示。已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以下信息和数据,下列说法正确的是
A.N4、N60、N70、高聚氮均是分子晶体
B.N4、N60、N70、高聚氮互为同素异形体
C.1molN4气体转变为N2将吸收882kJ热量
D.N4沸点比N70低
第Ⅱ卷(非选择题,共50分)
19. 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:
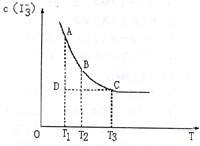
 I2(aq)+I-(aq) I3-(aq)上述平衡体系中,I-3的物质的量浓度c(I3-)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
I2(aq)+I-(aq) I3-(aq)上述平衡体系中,I-3的物质的量浓度c(I3-)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
A.该反应的正反应是放热反应
B.A点与C点的化学反应速率vA<vC
C.在反应进行到D点时, v正<v逆
D.A点与B点相比,B点的c(I2)大
18.CaC2和MgC2都是离子化合物,下列叙述中正确的是
 A.CaC2和MgC2与水反应都生成乙炔
A.CaC2和MgC2与水反应都生成乙炔
B.C2-2的电子式是:
C.CaC2在水中以Ca2+和C2-2形式存在
D.MgC2的熔点低,可能在100℃以下
17.将质量分数为a%的稀硫酸蒸发掉一定量水,使其质量分数为2a%,如果用c1和c2分别表示溶液蒸发前和蒸发后的物质的量浓度,则c1与c2的关系是
A.c1=2c2 B.c2=2c1 C.c2>2c1 D.c2<2c1
16.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液。由于浓度不同而能发生不同氧化还原反应的是
A.①③ B.③④ C.①② D.①③④
15.下列叙述中正确的是
① CO2是由极性键构成的非极性分子
② 由于氢键的作用,水的稳定性强于硫化氢
③ 离子晶体一定含有离子键,分子晶体中一定含有共价键
④ 在晶体中只要有阴离子就一定有阳离子
⑤ 原子晶体的熔点一定比金属晶体的高,分子晶体的熔点一定比金属晶体的低
⑥ 二氧化硅和氯化钠熔化时所克服的化学键类型不同
A.①④⑤ B.②④⑤ C.①④⑥ D.①③⑥
14.如图所示元素周期表前四周期一部分,关于元素X、Y、Z、W的叙述正确的是
① X、Y的最高价氧化物的水化物的酸性为Y<X
② Y、Z的气态氢化物的稳定性Y<Z
③ W的单质常温下呈液态,可与铁粉反应
④ W的原子序数比Z大9
⑤ W所在的周期中包含有32种元素
⑥ 标准状况下,22.4LR单质所含的原子数为2NA
A.只有③⑥ B.①②⑤ C.①②③ D.①②③④
13.在溶液中加入足量的Na2O2后仍能大量共存的离子组是
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
 C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
12.下列离子方程中错误的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO2-4=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH+4+HCO-3+2OH-=NH3·H2O+CO2-3+H2O
C.苯酚钠溶液中通入过量CO2:
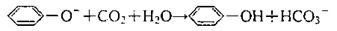
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+2Cl-
11.右图为氯化钠的晶体结构模型,下列说法不正确的是
A.NaCl晶体中Na+与Cl-的个数比为1︰1
B.每个Na+周围距离最近的Cl-数为6
C.每个Na+周围距离最近的Na+数为8
D.和Na+距离相等且最近的Cl-构成的多面体是正八面体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com