
题目列表(包括答案和解析)
4.下列排列的顺序正确的是( )
①热稳定性:H2O>HF>H2S ②熔点:Al>Na>K
③碱性:Mg(OH)2>Al(OH)3>Li
OH ④结合质子能力:CO32->HCO3->SO42-
A.①③ B.②④ C.①④ D.②③
3.下列有关化学用语的说法中不正确的是( )
 A.次氯酸的结构式为:H-Cl-O B.-OH与 都表示羟基
A.次氯酸的结构式为:H-Cl-O B.-OH与 都表示羟基

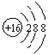

C.S2-的结构示意图:S2-
D.苯分子的模型示意图:

2.设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.常温常压下33.6LCl2与足量Fe反应,转移的电子数为3nA
B.1molNO2与足量H2O反应,转移的电子数为nA
C.由CO2和O2组成的混合物中共有nA个分子,其中的氧原子数为2 nA
D.1L 1mol·L-1的Na2CO3溶液中含有nA个CO32__
1.焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是( ) 
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时火焰均有颜色

C.焰色反应均应透过蓝色钴玻璃观察 D.NaC1与Na2CO3灼烧时火焰颜色相同
21、(12分)物质结构与性质
(1)图A是某短周期元素M的部分电离能变化情况。M元素位于周期表的第 族。
(2)图B是部分同主族元素氢化物沸点的变化规律图像。不同同学对某主族元素氢化物沸点的变化趋势画出了两条折线a和b,正确的是 (填“a”或“b”),理由是
。
错误!嵌入对象无效。 A B
(3)甲、乙两种氢化物分子中,中心原子的轨道杂化方式相同,但甲、乙两分子的立体结构不同,原因是 。请写出一种与甲、乙两分子中的中心原子相互结合形成的三原子分子互为等电子体的离子的化学式 。
(4)下图是常见金属晶体的四种堆积模型:
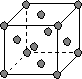



A B C D
(简单立方) (钾型) (镁型) (铜型)
请判断下列四种金属晶体分别对应的堆积模型:
Po Fe Zn Ag
20、(8分)800℃时,在2L密闭容器内充入0.50molNO和0.25molO2 ,发生如下反应:
 2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
|
t(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.50 |
0.35 |
0.28 |
0.25 |
0.25 |
0.25 |
(1)能说明该反应已达到平衡状态的是 。
A、v(NO2)正=v(O2)逆 B、容器内压强保持不变
C、v(NO)逆=2v(O2)正 D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 。
A、适当升高温度 B、缩小反应容器的体积
C、增大O2的浓度 D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K。
(4)将上述反应进行到4s时的混合气体用足量的水吸收,为保证混合气体中NO、NO2全部转化为HNO3,计算还需通入的O2的体积(折算成标准状况)。
18、(10分)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机。这类材料中研究得较多的是化合物G。
(1)化合物G的相对分子质量为140,G中硅元素的质量分数为60%,另有元素Y。G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体。请推断:①化合物G的化学式为 , ②1mol NH3 和0.75molE恰好完全反应生成G和HCl,则化合物E的分子式为 。
(2)粉末状G能够与空气中的氧气和水作用,所得产物中都有一种酸性氧化物,它是工业上生产玻璃的主要原料。与氧反应所得的产物还有一种单质,与水反应生成另一种产物是该种单质元素的氢化物。请写出化合物G与水反应的化学方程式 ;
(3)为了使化合物G能成为新一代汽车发动机材料,现采用常压下在G中添加氧化铝,经高
温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表达为Si6-xAlxOxY8-x。在接近于1700℃时x的极限值约为4.0,在1400℃时x为2.0,以保持整个化合物呈电中性。试问:①赛伦中Y元素的化合价为: 。赛伦的晶体类型为 。


请回答下列问题
(1)B有多种同分异构体。其中属于过氧酸(含 -C-OOH)且分子中有3个甲基的链状同分异构体有 种。
(2)D的结构简式为 ;
(3)E转变成F的过程中涉及的有机反应类型有三种,分别是取代、 。
(4)F转化为G的反应分两步进行,均为取代反应。写出两步反应的化学方程式:
① ;
② 。
(5)维生素B6分子中的“-CH2OH”在一定条件下被氧化成“-COOH”而形成二元酸。该二元酸在一定条件下与物质G通过肽键能形成具有不同链节的高分子化合物,请写出其中一种的结构简式 。
17、 (10分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42-等杂质,提纯工艺线路如下:
(10分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
 Na2CO3·10 H2O Na2CO3·7H2O Na2CO3·H2O
Na2CO3·10 H2O Na2CO3·7H2O Na2CO3·H2O
32 36 t(℃)
Ⅱ、有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“趁热过滤”时的温度应控制在 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行 ,并说明理由 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol-1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
16、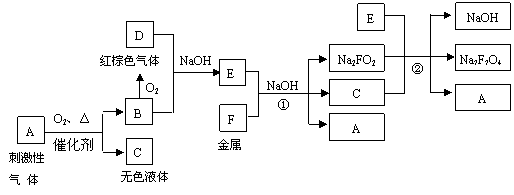 (10分)有下列物质之间的相互转化:
(10分)有下列物质之间的相互转化:
已知E是具有还原性的含氧酸钠盐,回答下列问题(方程式中的物质用对应的元素符号或化学式表示)
(1)写出A和O2反应生成B和C的方程式: 。
(2)Na2FO2和Na2F2O4均为易溶于水的盐。Na2FO2溶于过量的新制氯水后形成黄色溶液,向该溶液中滴入KSCN溶液出现血红色。写出反应②以及Na2FO2溶于过量氯水的离子方程式: 、 。
(3)事实上,金属F放置于一定浓度NaOH和E混合溶液中一段时间,发生反应①、②,生成的Na2FO2和Na2F2O4能发生可逆反应,在F表面生成一层致密的氧化物保护层。试写出Na2FO2和Na2F2O4相互反应生成保护层的化学反应方程式为:
。
(4)为防止金属F的腐蚀,将F制品放置于一定浓度NaOH和E混合溶液中时,NaOH的浓度不宜 (填“太小”或“太大”)。
15、(10分)实验室制备甲酸铜的过程如下:

(1)生成碱式碳酸铜的离子方程式为 。
(2)操作a的名称是 。向小苏打和胆矾研磨混合后的混合粉末中加入70℃-80℃的热水应少量多次,以防止温度过高发生副反应。温度过高可能产生的现象是
。
(3)“趁热过滤”中,“趁热”的原因是 。
用无水乙醇洗涤晶体的目的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com