
题目列表(包括答案和解析)
7. 将1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。此时若移走0.5molO2和0.5molSO2,则反应达到新的平衡时,SO3的物质的量为:
A.0.3mol B.0.15mol
C.小于0.15mol D.大于0.15mol,小于0.3mol
6. 在密闭容器中进行下列反应:M(g)+N(g)
在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,此反应符合下面图像,下列叙述正确的是
R(g)+2L,此反应符合下面图像,下列叙述正确的是
A. 正反应吸热,L是气体 B. 正反应吸热,L是固体 C. 正反应放热,L是气体 D. 正反应放热,L是固体或液体
5. 温度一定时, 于密闭容器中发生可逆反应: mA(气)
+ nB(气)  pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是
A. 平衡向逆反应方向移动 B. C气体的体积分数增大
C. 气体A的转化率升高 D. m + n > p
4. 在密闭容器中进行化学反应:2SO2 + O2 2SO3。已知反应过程中某一时刻SO2、O2、SO3浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时可能存在的数据是
2SO3。已知反应过程中某一时刻SO2、O2、SO3浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时可能存在的数据是
A、SO2为0.4mol/L、O2为0.2mol/L B、SO2为0.25mol/L
C、SO2、SO3都为0.15mol/L D、SO2为0.4mol/L
3.下列物质中,不能用硫蒸气与金属直接化合得到的是
A.Cu2S B.Fe2S3 C.FeS D.Na2S
2.氯仿(CHCl3)可以作为麻醉剂,常因保管不善被空气氧化,生成剧毒物质光气(COCl2):2CHCl3+O2→2HCl+2COCl2,为防止出现医疗事故,使用前要检验其是否变质,应选用的试剂是 ( )A.NaOH溶液 B.溴水 C.酚酞试液 D.AgNO3溶液
1、1998年,美国科学家合成出具有极强爆炸性的“N5”,但对其结构尚不十分清楚,只知“N5”实际是带正电荷的分子碎片。若“N5”的空间结构呈V型对称,5个氮原子最外电子层都达8电子结构,且含2个N≡N,将其视为“N5n+”,则n值为
A.1 B.2 C.3 D.4
20.(8分)如图:横轴表示溶液的pH,纵轴表示Zn2+离子或[Zn(OH4)]2-。P离子(配离子)物质的量浓度的对数,回答下列问题。
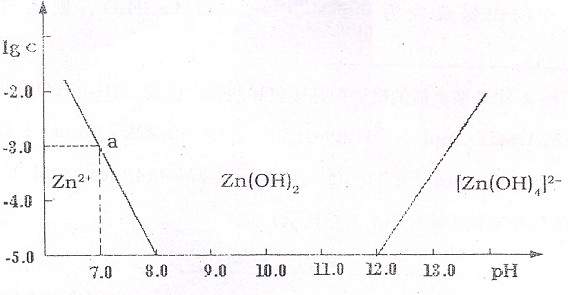
(1)往ZnCl2溶液中加入过量的氢氧化钠溶液,反应的离子方程式可表示为
。
(2)从图中数据计算可得Zn(OH2)。的溶度积(Ksp)= 。
(3)某废液中含Zn2+离子,为提取Zn2+。离子可以控制溶液中pH的范围是 。
(4)往1 L 1.00 mol ·L-1。ZnCl2。溶液中加入NaOH固体至pH=6,需NaOH mol (精确到小数点后2位,忽略溶液体积变化)。
19.(14)某学习小组在实室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,以及稀硫酸和宽度、厚度均匀的纯镁带测定气体摩尔体积,假如实验是在标准条件下进行,试回答下列问题:
(1)甲乙两试管各有两根导管,用橡胶管连接对应接口后,若倒置盛稀硫酸的试管,可发生反应放出气体。镁带和稀硫酸应分别置于 、 仪器中(填仪器编号);接口的连接方式是A接 ,B , C接 (填写各接口的编号)
(2)仪器丙由左右两部分组成,它们用橡胶管连通,并装入适量水(含少量食盐)。G管可以用化学实验室中的一种常用仪器改装,该仪器的名称是 。反应结束后读数时,除应将温度恢复至0℃,还应采取的措施是 。
(3)实验中要取用一定质量的镁带投入试管中,取用的质量应小于 g;取用实
验需要的镁带,能否用化学室常用的托盘天平 ,理由是 ;正确取用镁带的方法是 。
(4)如果镁带长Lm,质量为mg。试验中截取镁带长xcm,产生气体的体积为VmL,
则测得标况下气体摩尔体积应表示为V(m)= 。
(5)实验中若取用的镁带表面部分被氧化,则导致测定结果 ;若稀硫酸取用不足量,则导致测定结果 ;若读数时量气管内液面高于水准管内液面,则导致测定结果 (填偏高、偏低或无影响)。
18.(13分)工业上生产硝酸铵的流程图如下:
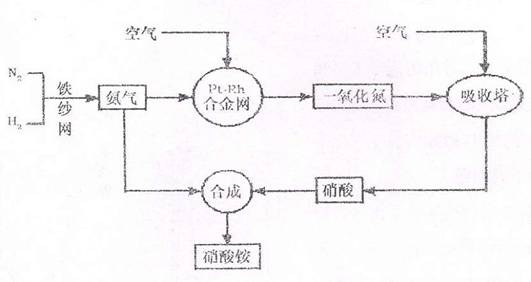
请回答下列问题:
已知N2(g)+3H2(g)⇌2NH3 (g),△H=-92.4kJ·mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1mol N2和3mol H2,充分反
应后,放出的热量 92.4kJ,(填“<”“>”“=”),理由是
.
②为有效提高合成氨反应的速率,实际生产中宜采取的措施有
A.降低温发 B.最适合催化剂活性的适当高温 C.增大压强 D.降低压强 E.循环利用 F.原料气中氮气和氢气的配比为1:2.8 G.及时分离出氨
(2)已知氨的催化氧化反应发生后,不需要继续加热,铂铑合金网仍然会保持红热。试写出该反应的化学平衡常数表达式K= ,当温度升高时,K值
(增大、减小、无影响),其原因是 。
(3)常温下某无色透明溶液中仅含有NH4+和NO3-等四种离子,请回答下列问题:
①该溶液所含的离子中除上述两种外还应有 (填离子符号)两种离子。
②该溶液所含的上述四种离子的物质的量浓度大小有多种可能。例如,可以是
c(NO3-)>c(NH4+)>c(H+)>c(OH-),也可以是c(NO3-)> c(H+)> c(NH4+)> c(OH-)。
请你再填写两种可能 , 。
③如溶液中c(NH4+)= c(NO3-)。则溶液中的溶质为 (填化学式),该溶液的Ph 7(填<、>或=)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com