
题目列表(包括答案和解析)
22.(14分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是 。解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
班级 姓名
21.(12分)海水中蕴藏着丰富的资源。海水综合利用的流程图如下。

(1)用NaCl做原料可以得到多种产品。
① 工业上由NaCl制备金属钠的化学方程式是__________________ __________。
② 实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为______ ___(忽略反应前后溶液的体积变化)。
③ 电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:_________ ___________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
 ① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为_______________,控制溶液的pH为____________________。
① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为_______________,控制溶液的pH为____________________。
② 在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:____________________________________________。
20.(10分)已知A-K所代表的各物质都是中学化学里常见的物质,且I是具有磁性的物质,D和K都具有两性。一定条件下,各物质间的相互反应转化关系如下图所示:
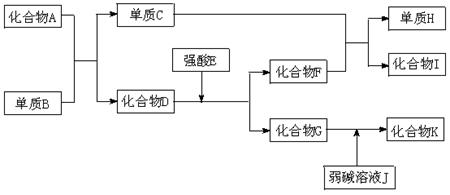
请回答:
(1)写出有关物质化学式:B是 ,D是 ,H是 。
(2)写出下列反应的方程式:
①化合物G的溶液不呈中性,其原因用离子方程式表示为 ,
②C+F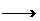 H+I 。
H+I 。
19.(18分)
Ⅰ.甲、乙两位学生用两种不同方法制取氮气。下面是甲、乙两位学生提出的两种制备氮气的实验方案(箭头表示气体的流向)。
甲:空气→碱石灰→红磷(点燃)→水→铜粉(灼热)→集气瓶
乙:NH4NO2(加热)→浓硫酸→镁粉(灼热)→集气瓶(NH4NO2 N2↑+2H2O)
N2↑+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制取氮气?甲_________、乙_________(填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此小题不用回答)_____________________________________。
(3)甲、乙方案中碱石灰和浓H2SO4可否交换位置?说明理由:___________________
___________________________________________。
Ⅱ. 某同学利用铁与水蒸气反应后的固体物质进行了如下实验:

(1)固体溶于稀盐酸的化学方程式为 。
(2)试剂1的化学式是 。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)
;
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2: ;
②设计方案:
为了对你所提出的假设2进行验证,实验方案是
。
18. 2006年11月23日中科院网报道,核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
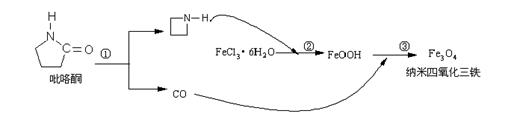
下列有关叙述不合理的是:
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.反应③的化学方程式是:6FeOOH +CO = 2Fe3O4 +3H2O + CO2
17. 将x mol Al2O3和y mol CuO混合后,全部溶于V L过量的稀硫酸中,然后向溶液中逐渐加入0.5 mol/L的NaOH溶液,当加入a L时,生成的沉淀最多,则原稀H2SO4的物质的量浓度为
A. mol/L B.
mol/L B.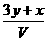 mol/L C.
mol/L C.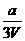 mol/L
D.无法计算
mol/L
D.无法计算
16.某原电池总反应离子方程式:2Fe3++Fe===3Fe2+,能实现该反应的原电池是
A.正极为C,负极为Fe,电解质溶液FeCl3溶液
B.正极为Fe,负极为C,电解质溶液Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质CuSO4液
15. 下列叙述正确的是
A.构成原电池的正极和负极必须是两种不同的金属
B.铁与稀H2SO4反应时,加入少量CuSO4溶液,可加快化学反应速率
C.在铁制的产品上电镀铜时,要用金属铜作阴极
D.用惰性电极电解NaCl饱和溶液,溶液的PH值不变
14.把铝粉和Fe3O4配成铝热剂,分成两等份,前一份在高温下恰好反应,并将生成物和足量的盐酸充分反应。后一份直接加入足量NaOH溶液使之充分反应,前后两种情况下生成的气体在同温同压下的体积比是
A.1∶1 B.9∶8 C.3∶4 D.4∶3
13.使Fe,Cu,Fe2+、Fe3+和Cu2+共处于同一容器内反应后铁有剩余,那么容器内还应存在
A.Cu,Fe3+ B.Fe2+,Fe3+ C.Cu,Cu2+ D.Fe2+、Cu
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com