
题目列表(包括答案和解析)
11.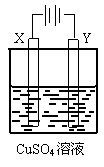 如右图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是
如右图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是
|
|
X电极 |
Y电极 |
通电后的变化 |
|
A |
石墨 |
石墨 |
Y电极质量增加,溶液的pH增大 |
|
B |
铁 |
铜 |
两电极的质量不发生变化 |
|
C |
铜 |
铁 |
X电极质量减小,Cu2+浓度不变 |
|
D |
铁 |
铂 |
Y电极:Fe2++2e-= Fe |
10. 下列各组离子在指定溶液中不能大量共存的是
A.无色溶液中:K+、Na+、Cl-、SCN-
B.pH=1的溶液中:NO3-、SO42-、Na+、Fe2+
C.使pH试纸变深蓝色的溶液中:Na+、CO32-、NO3-、AlO2-
D.水电离出的C(H+) = 10-12 mol/L的溶液中:Na+、Ba2+、Cl-、I-
9. 下列溶液中各微粒的浓度关系正确的是
A.NaHCO3溶液中:c(H+) + c(Na+) =c(CO32-) + c(HCO3-) + c(OH-)
B.含NH4+ 物质的量浓度相等的NH4HCO3、NH4HSO4、NH4Cl三种溶液的物质的量浓度关系为:c(NH4HCO3)>c(NH4Cl)>c(NH4HSO4)
B.NaHCO3溶液中:c(H+) + c(Na+) =c(CO32-) + c(HCO3-) + c(OH-)
C.1.0 mol/L 的Na2CO3溶液:c(OH-) = c(H+) + c(H2CO3) + c(HCO3-)
D.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合:c(Na+) > c( CH3COO-) > c(OH-) > c(H+)
8. 从下列实验事实所得出的相应结论不正确的是
|
|
实 验
事 实 |
相 应 结 论 |
|
A |
给试管中某红色溶液加热,溶液颜色逐渐变深 |
原溶液可能是滴有酚酞的Na2CO3溶液 |
|
B |
某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝 |
该溶液含有NH4+ |
|
C |
配制0.5 mol/L NaCl溶液,定容时俯视容量瓶刻度线
|
溶液浓度偏高 |
|
D |
根据分散系是否具有丁达尔现象 |
区分溶液、胶体和浊液 |
7.下列叙述中正确的是
A.氯气跟水反应时,水作还原剂
B. 在卤化钠中,最不易被氧化的是氟化钠
C.SO2能使溴水褪色可证明SO2具有漂白性
D.常温下浓硫酸可用铁槽车储运,说明常温下浓硫酸与铁不反应
6. 化学与科技、社会、生产、生活密切相关,下列有关说法不正确的是
A.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是刺激货币流通,应对2008年世界性的“金融危机”
 B.2008年8月8日,北京奥运会开幕式上的绚丽焰火是焰色反应的见证
B.2008年8月8日,北京奥运会开幕式上的绚丽焰火是焰色反应的见证
C.“神七”航天员的舱内航天服主要成分是由碳化硅陶瓷和碳纤维复合而成,它是一种新型无机非金属材料
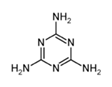
D.不法分子在奶粉中加入三聚氰胺(如图,分子式为C3N6H6),主要是其氮的质量分数高达66.7%,能显著提高蛋白质检测含量
34.(12分) 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
错误!嵌入对象无效。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴乙中反应的离子方程式为__________________________________
⑵乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是______(填字母)
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
⑶丁在实验中的作用是____________________________
装有碱石灰的干燥管的作用是____________________________
⑷戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于________
请说明该测得值与实际处理的百分率相比偏高还是偏低_________?简要说明可能的原因________________________________________________________。
⑸请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂)
_________________________________________________________________________
33.(10分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期元素组成的单质中熔点最高的金属,K是一种气体。
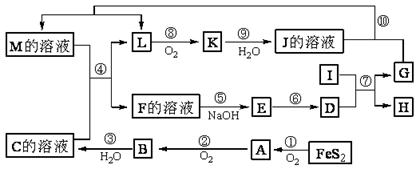
请填写下列空白:
(1)组成单质G的元素在周期表中的位置____________。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是 (填写序号)。
(4)反应④的离子方程式是: 。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是: 。
32.(10分)L、M、R、P、Q分别代表五种含不同化合价氮元素的常见物质,A、B分别代表两种含不同化合价的氯元素的物质(每种物质中,氮或氯元素的化合价只有一种),又知物质M中的氮元素的化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平)。
①P+A→Q+B ②L+O2→M+H2O ③L+M→R+H2O ④B+H2O→A+O2
(1)若五种氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应②必须在催化剂作用下,加热到一定温度时方能发生.此反应在化工生产上有重要用途。据此推断在同温、同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为 。
(3)某学生写出下面三个含氮元素的物质的相互转化的关系式
A.M + P→N2O3 + H2O B.N2O +H2O → P + M C.M+L → Q + H2O
其中一定不可能实现的是 ,理由是 。
30.如右图,在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器。在Ⅰ、Ⅱ中分别加入2 mol A和2 mol B,起始时容器体积均为V L,发生如下反应并达到化学平衡状态: 2A十B xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是 (
)
xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是 (
)
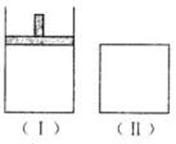 A.x的值为3
A.x的值为3
B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同
D.平衡时,Ⅰ容器的体积小于V L
Ⅱ卷(非选择题,共40分)
31.(8分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为9。又知B、D、E分别与A、C两元素形成的三种化合物X、Y、Z之间能相互发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,1molM中含有42mol电子。回答下列问题:
(1)元素C在周期表中的位置是 ______ ;
(2)化合物M中含有的化学键类型有 ______ ;
(3)写出化合物Y与Z之间反应的离子方程式 ______________________ ;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则正极上的电极反应式为 _______________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com