
题目列表(包括答案和解析)
4.下列有关能量转换的说法不正确的是
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成化学能的过程
3.有些化学仪器加热时需要填在石棉网上,但也有一些仪器可以直接在酒精灯上加热,
下列各组仪器中可以用酒精灯直接加热的一组是:
A.试管、蒸发皿 B.试管、烧杯
C.试管、平底烧瓶 D.蒸发皿、圆底烧瓶
2.下列反应不是氧化还原反应的是
A.Fe+H2SO4(稀)=FeSO4+H2↑
B.H2+CuO Cu+H2O
Cu+H2O
C.3NO2+H2O=2HNO3+NO
D.Ca(HCO3) 2 CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
1.下列物质中碱性最弱的是
A.氢氧化钠 B.氢氧化镁 C.氢氧化铝 D.氢氧化钙
20.(16分)已知烯烃在一定条件下可被强氧化剂氧化成醛,例如:
RCH=CHR′
 RCHO + R′CHO
RCHO + R′CHO
从A出发有下图所示关系:
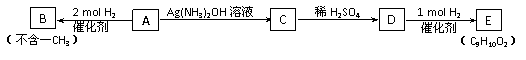
(1)A的化学式为________________,E的结构简式为_____________________;
A→C的化学反应方程式为:_____________________________________。
(2)若B的一种同分异构体跟溴水反应生成白色沉淀,且1mol该同分异构体跟溴水反应时,需消耗3mol Br2,则符合该条件的同分异构体有_______种,写出其中任意一种的结构简式:_______________________;
(3)A是一种可以作为药物的有机物,将A在一定条件下氧化可以得到两种有机酸X和Y,X属于芳香族化合物,它在食品保存及染料、药物生产中均有重要作用,则X的结构简式为:___________________________;
(4)由A制E还可以通过以下途径:
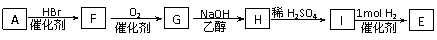
①设计步骤A→F的目的是_______________;
②写出G→H的化学反应方程式:_______________________。
19.(16分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。

A B C D E F G
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g;再次加热并冷却室温称量其质量为m2g,且m1-m2=0.3,接下来的操作应当是 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为
(列出算式,不需化简)。
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的。你认为甲学生的观点是否正确? (填“正确”或“错误”),请说明理由:
。
18.(10分) 科学家用NaNO3和Na2O在一定条件下等物质的量化合制得晶体A,A由钠离子和某阴离子B构成, 则:
(1)A的化学式为 , A 与Na3PO4比较,其稳定性A Na3PO4(填“>”或“<”),阴离子B的空间结构最有可能是 (填序号);
①直线型 ②平面三角形 ③三角锥形 ④正四面体
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为: ;
(3)此外,科学家还制备了另一种钠盐D,其与A的组成元素完全相同,D中的阴离子与A中的阴离子表观形式相同(元素种类和原子个数均相同),但D中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,该阴离子的化学式为 ,其与水反应生成过氧化氢的离子方程式为 ,该反应 (填“是”或“不是”)氧化-还原反应。
17.(10分)现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下均为液态;A分别与E、F形成电子总数相等的气体分子。
请回答下列问题:
(1)元素F在周期表中的位置是 ;
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为 ;生产该化合物和单质F的工业称为 工业;
(3)B与F形成的化合物分子中,各原子均达8电子结构,则该分子的电子式为 ;
(4)已知0.5 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为 ;
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,晶体类型为 。
16.将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用l mol·L-1的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL,原合金中钠的质量为
A.0.46 g B.0.69 g C.0.92 g D.0.23 g.
温馨提示:第17~20题为非选择题,答案直接写在答题卷上对应的答题区域内。
15. 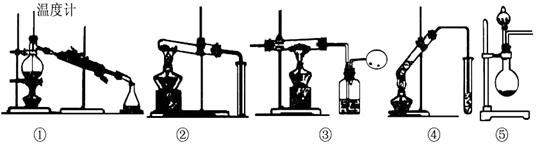 以下均为中学化学中的常见实验装置,下列有关说法不正确的是
以下均为中学化学中的常见实验装置,下列有关说法不正确的是
A.装置①用于分离沸点不同的两种液态有机物,装置④适用实验室制取少量乙酸乙酯
B.装置②可用于检验碳酸钠与碳酸氢钠两种固体
C.装置③,可用于CO还原氧化铁实验
D.装置⑤,选择合适药品时,可用于制备少量氨气及氧气等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com