
题目列表(包括答案和解析)
2、用32P标记的噬菌体侵染大肠杆菌,经培养、搅拌、离心、检测,上清液的放射性占15%,沉淀物的放射性占85%。上清液带有放射性的原因可能是 ( )
A.离心时间过长,上清液中析出较重的大肠杆菌
B.搅拌不充分,吸附在大肠杆菌上的噬菌体未与细菌分离
C.噬箘体侵染大肠杆菌后,大肠杆菌裂解释放出子代噬菌体
D.32P标记了噬菌体蛋白质外壳,离心后存在于上清液中
1、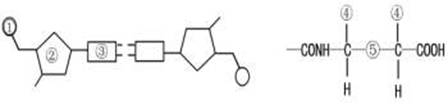 在证明DNA是遗传物质的实验中,赫尔希和蔡斯分别用32P和35S标记噬菌体的DNA和蛋白质,在下图中标记元素所在部位依次是 ( )
在证明DNA是遗传物质的实验中,赫尔希和蔡斯分别用32P和35S标记噬菌体的DNA和蛋白质,在下图中标记元素所在部位依次是 ( )
A.①、④ B.②、④ C.①、⑤ D.③、⑤
5.(16分)物质的性质是由物质的组成和结构决定的。
乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
|
名 称 |
分子式 |
颜色、状态 |
溶解性(g) |
熔点(℃) |
密度(g/cm3) |
|
乙二酸 |
H2C2O4 |
-- |
8.6(20℃) |
189.5 |
1.900 |
|
二水合乙二酸 |
H2C2O4·2H2O |
无色晶体 |
-- |
101.5 |
1.650 |
注:表中“--”是尚未有具体数据。
回答下列问题:
(1)向盛有Na2CO3粉末的试管里加入约3mL乙二酸溶液,观察到的现象为
;说明二乙酸的酸性比碳酸 。
(2)向盛有5mL乙二酸饱和溶液的试管中滴入3滴硫酸化的0.5%(质量分数)的KMnO4
溶液,振荡,观察到现象为 ;说明二乙酸有 。
(3)向A试管中加入3mL乙醇,然后,边振荡试管边加入2mL浓硫酸和2mL乙二酸,
按图一连接好装置,加热3-5min,在B试管中有油状、香味液体产生。该现象说
明发生了 反应(填有机反应类型)。在B试管中加入饱和Na2CO3溶
液的目的是 ;
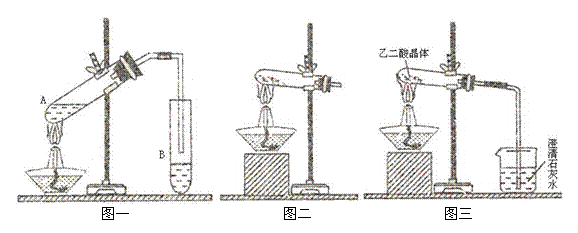 导管在液面上的原因是
。
导管在液面上的原因是
。
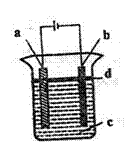
(4)图二是中学化学实验常用的装置,用此装置可制备的气体是 (填标号)。
A.O2 B.H2 C.Cl2 D.NH3 E.CH2=CH2 F.CH≡CH
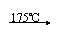 图二试管中略低于试管底部的原因是
。
图二试管中略低于试管底部的原因是
。
已知草酸分解的化学方程式为H2C2O4 H2O+CO2↑+CO↑。用图三加热草酸晶体,
验证草酸受热分解及其产物,是中学化教材中给出的实验装置图,但有人认为该装置不
合理。请你根据草酸晶体的某些物理常数和实验目的,指出图三不合理的原因。答:
。
该装置也不符合绿色化学的要求,因为 。
4.(10分)实验室可通过多条途径得到氮气,常见的三种方法是:
方法一,将氨气通入灼热的氧化铜粉末,得到纯净氮气和铜。
方法二,将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三,将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
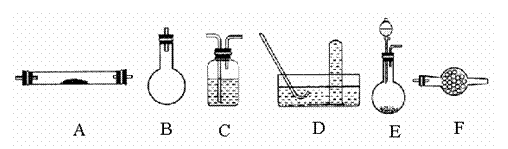 下列是进行实验进可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未列出):
下列是进行实验进可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未列出):
请回答下列问题:
(1)方法一制氮气;氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号) 作发生装置,该反应的化学方程式
。要制取并收集纯净的氮气(可含有少量的水),还使用上述仪器中的(填仪器的编号,并按气流方向人左向右列出)
。
(2)在制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于
。
3.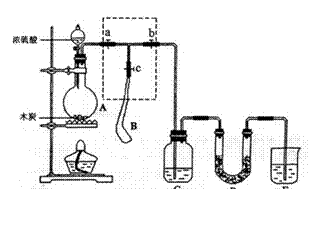 (14分)为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图11所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
(14分)为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图11所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是
;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水b;
(3)实验时,装置C中的现象为 ;
(4)当D中产生 (多选不得分)现象时,可以说明使E中澄清石灰水变浑的CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
则装置D的作用为
2.(12分)实验室有甲、乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定甲、乙两瓶溶液的成分及其物质的量浓度,现操作如下:
①量取25.00mL甲溶液,向其中缓慢滴加乙溶液15.00mL,共收集到二氧化碳气体224mL。
②另取15.00mL乙溶液,向其中缓慢滴加甲溶液25.00mL,共收集到二氧化碳气体112mL。
上述气体体积均已换算为标准状况,则根据上述操述及实验数据填空:
(1)写出上述过程所涉及反应的离子方程式
;
(2)甲是 ,甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为 ;(二氧化碳在溶液中的少量溶解忽略不计)
(3)将n mL的甲溶液与等体积的乙溶液按各种可能的方式混合,产生的气体体积为V mL(标准状况),则V的取值范围为 。
1.(17分)已知:①无水氯化钙可与乙醇形成难溶于水的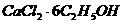 。
。
②有关有机物的沸点:
|
试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
|
沸点(℃) |
34.7 |
78.5 |
118 |
77.1 |
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液。试回答:
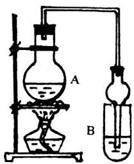
(1)A中浓硫酸的作用是_______;若用同位素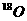 示踪法确定反应产物水分子中氧原子的提供者,写出能表示
示踪法确定反应产物水分子中氧原子的提供者,写出能表示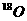 位置的化学方程式:____________________________。
位置的化学方程式:____________________________。
(2)B中球型管的两个作用是______________、______________。若反应前向B中溶液滴加几滴酚酞,呈红色,产生此现象的原因是(用离子方程式表示)_______________;反应结束后B中的现象是___________________________。
(3)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出__________;再加入(此空从下列选项中选择)________,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
22.某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
21.(10分)室温下,单质A、B、C分别为固体、黄绿色气体与无色气体,在合适条件下,它们可以按下面的流程进行反应。又知E溶液是无色的。请回答:
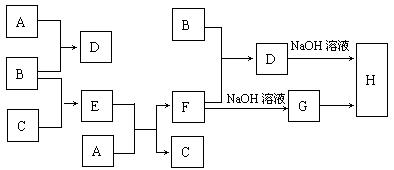
(1)写出下列物质的化学式:
A 、B 、C 。
(2)写出G→H的化学方程式 。
(3)写出B+F→D的离子方程式 。
20.(11分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4后层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验① ;
实验② ;
实验③ ;
实验④ ;
实验⑤ ;
(2)上述5个实验不能确定是否存在的离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com