
题目列表(包括答案和解析)
5.在温室下,一元酸HA的溶液与一元碱BOH的溶液等体积混合,下列有关判断正确的是
( )
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸,碱pH之和等于14,混合后所得溶液呈碱性,则HA肯定是弱碱
C.若混合前酸,碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足:
c(B+)>c(A-)>c(H+)>c(OH-)
4. X、Y、Z和R为原子序数依次递增的四种元素。其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素。下列说法不正确的是 ( )
A.127R-的核外含有54个电子
B.Y、Z、R的氢化物的稳定性逐渐减弱
C.有1mol Y的单质与水发生反应则转移电子的物质的量为2mol
D.在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色
3. 2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。合成氨反应在铁催化剂表面进行时效率显著提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是 ( )
A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,且有利于平衡向合成氨的方向移动
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
2.下列各组离子在溶液中能大量共存,且加入过量NaOH溶液后可得到澄清溶液的是( )
A.Na+,Cu2+,Cl-,SO42- B.Al3+,Na+,Cl-,NO3-
C.Ag+,K+,SO42-,Cl- D.K+,Ba2+, HCO3-、C1-
1.下列叙述中不正确的是 ( )
A.“水滴石穿”的原因之一是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2
B. 长期存放NaOH溶液的滴瓶不易打开,是因为NaOH与玻璃中的SiO2反应,其产物将玻璃粘住
C. 塑料袋全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解
D.木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同分异构体
22、答案:(1)
(2)羟基 羧基 ②加成反应 消去反应

③
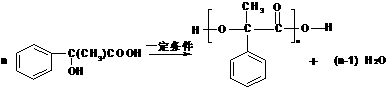
④



本资料由《七彩教育网》 提供!
22. (本题12分)肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。现测出A的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:
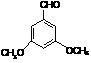
 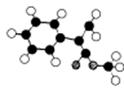 (2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示
(图中球与球之间连线表示单键或双键)。 (2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示
(图中球与球之间连线表示单键或双键)。用芳香烃A 为原料合成G的路线如下:  ① 化合物E中的官能团有 (填名称)。 ② A→B的反应类型是 ,E→F的反应类型是 , ③ 书写化学方程式 C→D  E→H E→H
④ 其中E的同分异构体甚多,其中有一类可用通式 表示(其中X、Y均不为H), 试写出符合上述通式且能发生银镜反应的 四种物质的结构简式 、 、 2009年天津市滨海新区五所重点学校高三毕业班联考 化学参考答案 一、1.A 2.B 3.C 4.D 5.B 6.A 7.D 8C 9.B 10.B 11.C 12.B 13.A 14.C 15A16.D 二、17、(1)2,10,2,1,3,5 (2)HNO3 (3)还原产物不止一种,NO与NO2比例不同时反应物的用量不同,系数不同 (4)a 取少量溶液 加KSCN溶液 出现红色 证明存在Fe3+ b 取少量溶液 逐滴加入高锰酸钾溶液,高锰酸钾紫色褪去 证明存在Fe2+ 18、(1) ① K= c(C)2 / c(A )· c(B)3 ② > ③ A ④ 2, >1-a (2) ① N2H62+ + H2O =可逆c([N2H5·H2O] +)+c(H+) ② D 19、(1)NaCl(2)HCl(3)2Cl- + 2H2O =电解= Cl2 ↑+ H2↑ + 2OH- Cl2+HSO3-+H2O = 2Cl- + SO42-+ 3H+ N2+ 3H2 高温高压催化剂= 2NH3 2Al + Fe2O3 高温= 2 Fe + Al 2O3 20、(1)2H2O2 = O2 ↑ +2H2O 电子式略 bc (2)①④(3)HS- + OH- = S2- +H2O (4)2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);△H= -114.6KJ/mol (5)负 O2 +2H2O + 4e- = 4OH- ① 能自发进行的氧化还原反应(有电子转移) ② 正反应为发热反应 21、(1) F(2) 2NH4Cl+Ca(OH)2=加热= 2NH3 ↑ + CaCl2 +2H2O (3)6NO + 4NH3 催化剂加热= 5N2 +6 H2O (4)① 使NO与NH3 充分混合 (5)CCl4(难挥发有机溶剂) 缺少尾气处理 (6) B
21. (本题7分)轿车进入家庭,给人们带来了极大方便,但排出的尾气给环境带来了污染。现在已经研制出了汽车尾气处理装置并已投入使用,它可将汽车尾气中的有害成分转化为对环境无害的物质。某研究小组利用如下装置模拟汽车尾气的处理过程,试回答下列问题:
(1)仪器的连接顺序为 (填仪器代号) (2) C中的化学反应方程式 (3)E中的化学反应方程式 (4)D装置的作用① ② 通过观察气泡数目调节气体流速
但D中的液体需改成 。即便如此,该实验还存在明显缺陷,你认为它是 (6)科学研究的最终目的是应用于生产与生活实际,造福人类。你认为汽车尾气处理研究的方向是 (填代号) A.选择适宜的氧化剂,适宜的温度,高效催化剂 B.选择适宜的还原剂,适宜的温度,高效催化剂 C.选择适宜的还原剂,高温,高效催化剂 20. (本题10分) A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,又知四种元素的单质常温常压下有两种气体、两种固体。请回答下列问题: (1)由A、B两种元素可形成E、F两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式__________________________。反应物的电子式 其所含化学键为 (a.离子键 b.极性共价键 c.非极性共价键) (2)B元素比D元素的非金属性强的依据是: 。 ①两元素组成的化合物中D元素为正价 ②单质的熔沸点的高低 ③最高价氧化物对应的水化物的酸性强弱 ④气态氢化物的稳定性 (3)由A、B、D三种元素中的两种可分别形成甲、乙两种粒子,它们均为负一价双原子核的阴离子,且甲含有18个电子,乙含有10个电子,则甲与乙反应的离子方程式为__________________________________________________________。 (4)写出C和D两元素的最高价氧化物对应的水化物在稀溶液里相互反应的热化学方程式(已知此反应生成1molH2O时放出的热量为57.3KJ) ___________________________________________________________________________________ (5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则M极是该电池的________极;N极的电极反应式为:________________________。 由此给我们的启示:在能量电池的设计上,对化学反应的要求是: ① ② 。 18.(本题8分)(1)在一定体积的密闭容器中,进行如下化学反应:
请完成下列问题: ① 该反应的化学平衡常数表达式为K= 。 ② 判断该反应的ΔH 0(填“>”或“<”) ③ 在一定条件下,不能判断该反应已达化学平衡状态的是 (填序号)。 A.3v(B)(正)=2v(C)(逆) B.D的物质的量不变 C.容器内压强保持不变 D.混合气体的密度保持不变 ④398K、1.01×105Pa在1L的密闭容器中加入1molA和3molB,达平衡时A的转化率为a,在相同条件下的另1L容器中,若要达到与前一容器中相同的气体浓度,则需加入 molC, D的取值范围为 mol。 (2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。 ①写出盐酸肼第一步水解反应的离子方程式 。 ②盐酸肼水溶液中离子浓度的排列顺序不正确的是 (填序号)。 A.c(Cl-) > c(N2H62+) > c(H+) > c(OH-) B.c(Cl-) > c(H+)> c([N2H5·H2O] +) > c(OH-) C.2 c(N2H62+)+ c([N2H5·H2O] +)+c(H+)= c(Cl-)+c(OH-) D.c(N2H62+) > c(Cl-) > c(H+) > c(OH-)
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分 请回答下列问题: (1)写化学式A X (2)蒸干灼烧E所得酸性气体为 (3)完成下列方程式 反应①的离子反应方程式 B通入H溶液的离子反应方程式 空气中含量最高的气体与C反应的化学反应方程式 反应②的化学反应方程式
同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |