
题目列表(包括答案和解析)
8.一定条件下反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是
A.2υ(A2)正=υ(AB)逆
2AB(g)达到平衡状态的标志是
A.2υ(A2)正=υ(AB)逆
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2∶2∶1的状态
7.在钢铁腐蚀过程中,下列五种变化可能发生的是 (①Fe2+转化为Fe3+、②O2被还原、③产生H2、④Fe(OH)3失水形成Fe2O3·xH2O、⑤杂质碳被氧化
A.只①② B.只②③④ C.①②③④ D.①②③④⑤
6.用石墨作电极,电解1 mol / L下列物质的溶液,溶液的pH值保持不变的是
A.HCl B. NaOH C.Na2SO4 D. NaCl
5.分别将下列物质 ①CuSO4 ②Na2O2 ③Na2CO3 ④NH4Cl ⑤FeCl3投入水中,并对其溶液加热蒸干和灼烧,仍能得到原物质的是
A.①②③ B.③⑤ C.①③ D.④⑤
4.在一固定体积的密闭容器中,加入2molA和1molB,发生反应如下;2A(气)+B(气)

3C(气) + D(气),当反应达到平衡时,C的浓度为Wmol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L是
A.4molA+2molB B. 3molC + 1molD
C.3molA +1molB +1molC D.1.5molC + 0.5molD
3.25℃时,若pH = a的10体积某强酸溶液与pH = b的1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系
A.a+b=14 B.a+b=13 C.a+b=15 D.a+b=7
2.为了使(NH4)2SO4溶液中c(NH4+)和c(SO42-)之比更接近2∶1,可向溶液中加入少量
A.硫酸 B.盐酸 C.氢氧化钠溶液 D.氯化钠溶液
1.下列条件一定能使反应速率加快的是:①增加反应物的物质的量②升高温度③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
31.(15分)某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验。
I.探究乙酸、碳酸和苯酚的酸性强弱关系。
该校学生设计了如下实验装置(夹持仪器已略去)。
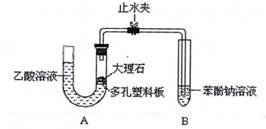
(1)实验前如何检查装置A的气密性? 。 ;大理石与乙酸溶液反应的化学方程式为 。
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 ,反应的离子方程式为 。
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,原因是 ,改进该装置的方法是
。
II.证明乙酸为弱酸。
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸。 。
30.(15分)某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H2密度的8.5倍。
请回答:
(1)乙的电子式为 。
(2)甲具有不稳定性,其发生分解的化学反应方程式为 ,实验室保存甲的方法是 。
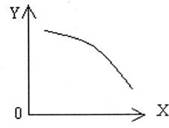 (2)在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0。达到平衡状态后,改变其中一个条件X,的
(2)在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0。达到平衡状态后,改变其中一个条件X,的
变化符合图中曲线的是 (选填
字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体
的密度
d.当X表示乙的物质的量时,Y表示某一
生成物的物质的量
(3)现有硫酸和甲的混合液20mL,其中硫酸的物质的量浓度为2mol ·L-1,甲的物质的量浓度为1mol·L-1。向该混合液加入0.96g铜粉,假设只生成一种无色气体,则所收集到的气体的体积在标准状况下为 。
(4)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是“结合离子方程式简要说明”
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com