
题目列表(包括答案和解析)
3.某溶液中含有NO3-、SiO32-、AlO2-、S2-等四种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量NaOH溶液,溶液中大量减少的阴离子是 ( )
A.NO3- SiO32- B.SiO32- S2- C.AlO2- NO3- D.S2- NO3-
2.第二次世界大战期间,某国有支侦察小分队到德国法西斯一座十分隐蔽且戒备森严的军火厂,上级要求小分队在三天内必须炸毁它,结果他们用十多只涂有化学药物的老鼠就顺利完成了任务。据你推测这种药剂是 ( )
A.TNT(烈性炸药) B.KMnO4和H2SO4
C.黑火药和硫 D.白磷和CS2溶液
1.生活中常用到一些化学知识,下列分析中正确的是 ( )
A.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水
B.某雨水样品放置一段时间后pH由4.68变为4.00,是因为水中溶解的CO2增多
C.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
D.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
22.(1分)氢气还原氧化铜的反应不完全时,便得到Cu、Cu2O、CuO的固体混合物。
化学兴趣小组同学为探究上述固体的成分进行了如下操作和实验:
(1)取一定质量的均匀固体混合物A,将其分成两等份。
(2)取其中-份用足量的氢气还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气
体2.24L。
请回答以下问题:
(1)A中,n(Cu)+n(Cu2O)= 。
(2)A中,n(CuO)的取值范围是 。
(3)试计算所用稀硝酸的物质的量浓度(要求有计算过程)。
21.(12分)下面是甲、乙两同学对草酸受热分解及其产物的检验做的探究:
甲、乙两同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
|
名称 |
分子式 |
颜色、状态 |
溶解性 |
熔点(℃) |
密度(g/cm3) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
189.5 |
1.900 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
1.650 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。
(1)猜想与假设:
第一种:草酸分解产物是CO2和H2;
第二种:草酸分解产物是CO2、CO和H2O;
第三种:草酸分解产物是CO2和H2O。
(2)实验装置的设计(图中铁架台略去)甲同学设计了如图1所示的装置。乙同学设计了如图2所示的装置。
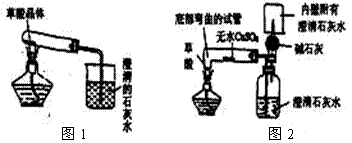
(3)实验:
甲同学按图(1)装置实验,观察到澄清石灰水变浑浊,……
乙同学按图(2)装置实验,观察到:
A、无水CuSO4变蓝;
B、广口瓶中澄清石灰水变浑浊;
C、生成的气体通过碱石灰后,在尖嘴处点燃后能燃烧,在火焰上方罩一个内壁附有澄清石灰水的烧杯,澄清的石灰水变浑浊。证明产物中有 。
(4)结论:
第 种猜想是正确的,请写出草酸受热分解的化学反应方程式 。
(5)反思与评价
乙同学认为甲同学设计的实验装置有缺陷。由于试管口向下倾斜,而且草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中常会出现熔融的草酸流进导管而影响后续实验。甲同学认为乙同学的设计是科学合理的。请你谈谈图2装置优于图1装置之处:
第一点: 。
第二点: 。
第三点: 。
乙同学设计的图2装置也能证明产物中无H2,证明方法是 。
20.(8分)某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
|
检测次数 |
溶液中检测出的离子 |
|
第一次 |
KCl、K2SO4、Na2CO3、NaCl |
|
第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
|
第三次 |
Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 次检测结果不正确。
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子:
首先,向溶液中滴加 溶液(填化学式),其目的是
;其次,然后继续加入过量的该溶液,其目的
是 ;第三,过滤,向滤液中加入 溶液(填化学式),其目的是 ;
第四,过滤,再向滤液中加入__________溶液(填化学式),其目的是
。
19.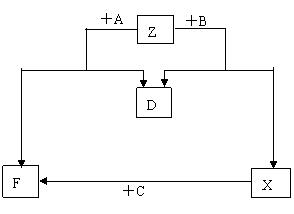 (10分)已知D是单质,其他均是常
(10分)已知D是单质,其他均是常
见的化合物,它们之间的转化关系
如下图所示,其中M(A)<M(B)。
回答下列问题:
(1)符合此转化关系的A、C的化学式
分别是:A__________、C__________。
(2)写出Z的电子式:_______________,
Z中阴阳离子数之比为:__________。
(3)若向X的水溶液中滴加几滴酚酞试液,
现象是 ,
出现此现象的原因用离子方程式表示为 ,然后再加入足量的BaCl2溶液,出现的现象是 ,原因是 。
(4)室温下,将2g苯和过量的D混合,完全燃烧,放出83.6kJ的热量,写出苯燃烧热
的热化学方程式____________________________________________________。
18.(14分)正确书写电极反应和化学方程式:
(1)铁在潮湿的空气中转变为铁锈
负极:
正极:
总反应:
氧化反应:
分解反应:
(2)正确书写离子方程式
向FeBr2 溶液中加入少量Cl2
向FeBr2 溶液中加入足量Cl2
17.(6分)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、
H2O。已知水是反应产物之一。
(1)该反应中还原剂是 ;
(2)该反应中还原产物是 ;
(3)若反应过程中转移了0.3mol电子,则生成水的质量是 g。
16.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应的化学方程式如下:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应的说法正确的是( )
A.CuSO4发生了氧化反应
B.生成1 mol H3PO4时,有10 mol电子转移
C.氧化产物和还原产物的物质的量之比为6∶5
D.白磷只作还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com