
题目列表(包括答案和解析)
18.(10分)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中。现以氯化钾和
磷酸为原料制取磷酸二氢钾,反应方程式为:H3PO4(aq)+KCl(aq) KH2PO4(aq)+HCl(aq),以下是在三正
KH2PO4(aq)+HCl(aq),以下是在三正
丁胺中制备磷酸二氢钾的工艺流程:


已知:三正丁胺是不溶于水的有机溶剂,与氯化氢反应生成一种可溶于水的盐,能使磷酸二氢钾在水中的溶解度降低。
(1)该流程中所获副产品氮肥的主要成份是 。
(2)使用三正丁胺能促进该反应进行的原因是 。除该方案外,促进该反应进行还可采取的措施有 。
(3)当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示。KDP晶体的一级品标准:Cl‑质量分数低于0.2%。
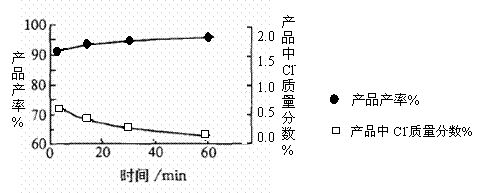
由图中可知,当反应进行到约 分钟时,KDP晶体达到一级品标准,此时的产品产率约为 。
17. (8分)利用天然气合成氨的工艺流程示意图如下:
(8分)利用天然气合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空:
(1)图中CH4的第一次转化过程中的化学方程式是 。
(2)脱硫过程中,若有n mol Fe2O3·H2O转化,则生成S的物质的量为 mol(用含n的代数式表示)。
(3)整个流程有三个循环:一是K2CO3(aq)循环,二是N2和H2循环,第三个循环中被循环物质是 。
(4)改用过量NaOH溶液吸收天然气中的硫化氢,以石墨作电极电解吸收后所得溶液可回收硫,其电解总反应方程式(忽略氧气的氧化还原)为____________________,该方法的优点是____________。
16.(10分)四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO·PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
①称取样品0.1000 g,加还原性酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(离子方程式为2PbCrO4+2H+=2Pb2++Cr2O72-+H2O),加入过量KI
溶液,再用Na2S2O3标准溶液滴定到终点(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。
(1) 已知Pb的原子序数是82,请写出Pb位于周期表的第_____周期______族。
(2)在PbCrO4浊液中加入少量酸,则Ksp(PbCrO4) (填“增大”、“减小”、“不变”)
(3)写出步骤③中加入过量KI后溶液中发生反应的离子反应方程式 。
(4)欲求试样中Pb3O4的质量分数,还需要的数据有 。
15.(10分)氯化亚铜(CuC1),白色结晶,微溶于水,不溶于硫酸、稀硝酸和醇,溶于氨水、浓盐酸,并生成配合物,它露置于空气中易被氧化为绿色的高价铜盐。氯化亚铜广泛应用于有机合成、染料、颜料、催化剂等工业。
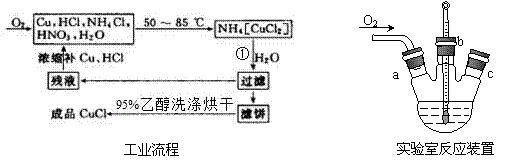
实验药品:铜丝20 g、氯化铵20 g、65% 硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为__________,用95%乙醇代替蒸馏水洗涤的主要目的是___________。
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择___方案(填字母序号)。
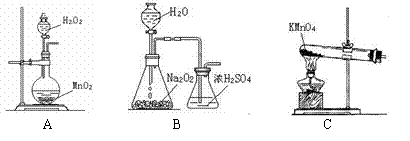
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是________________;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当___________时停止通入氧气,打开瓶塞,沿__________(填字母)口倾出棕色反应液于1 000 mL大烧杯中,加水500 mL,即刻有大量白色沉淀析出。
(4)工业化生产时,95%乙醇可通过______方法循环利用,而_________、_________可直接循环利用。
14. 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
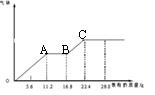 下列分析或结果错误的是
下列分析或结果错误的是
A.混合酸中NO3-物质的量为0.2mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+ ,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.H2SO4浓度为5mol/L
第Ⅱ卷(非选择题,共72分)
13.电镀等工业废水中常含有剧毒、致癌的Cr2O72-。该废水处理的一种方法是:利用还原剂把Cr2O72-还原成毒性较低的Cr3+,再加碱生成沉淀。另一种方法是:向废水中加入适当的NaCl,用Fe作电极进行电解。下列说法错误的是:
A.电解时,阳极反应为:Fe-2e-=Fe2+
B.电解过程中阴极能产生氢气
C.电解法中,转化Cr2O72-的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D.电解过程中,阳极附近生成Fe(OH)3和Cr(OH)3沉淀
12. X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子最外层电子数是其电子层数的3倍。Z原子的核外电子数比X原子少1。M是同周期中半径最大的元素(除稀有气体元素)。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.Z和M组成的化合物为离子化合物,它与盐酸反应可以生成两种盐
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>Z>X>M
11.HPE是合成除草剂的重要中间体,其结构简式如下图所示。下列有关HPE的说法正确的是
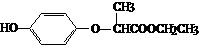 A.1molHPE最多可以和2mol NaOH反应
A.1molHPE最多可以和2mol NaOH反应
B.HPE不能跟浓溴水反应
C.HPE在核磁共振氢谱中有6种
D.HPE分子中有2个手性碳原子
10.下列说法错误的是
A.对于反应C(s)+ CO2 (g) =2CO(g) △H >0 ,升高温度会加快化学反应速率
B.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡
C.将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者
D.对于反应PCl5(g)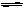 PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com