
题目列表(包括答案和解析)
4.设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1molCl2与足量Fe反应,转移的电子数为3NA
B.1.5 mol NO2与足量H2O反应,转移的电子数为1.5NA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
D.0.10mol Na2O2粉末与足量水反应生成的O2分子数为0.10NA
3.下列叙述正确的是
A.元素的单质一定由氧化或还原该元素的化合物制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
2.下列关于化学学习和研究的说法错误的是
A.化学模型有助于解释一些化学现象
B.质量守恒定律是大量试验事实的总结
C.化学家提出的假设都能被试验证明
D.化学基本原理的应用是有一定条件的
1.食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是
A.三聚氰胺的含量 B.二氧化硫的含量
C.亚硝酸盐的含量 D.淀粉的含量
0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
23.(8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为
22.(共9分)物质A、D及F的水溶液均呈黄色,D是单质,F的溶液遇苯酚显紫色,A是一种重要工业生产中的主要原料。且A、C、D均含有某一非金属元素,C的相对分子质量与过氧化氢的相对分子质量相等。反应过程中生成的水等与转化无关的物质已经略去。这些物质有以下转化关系。试回答以下问题:
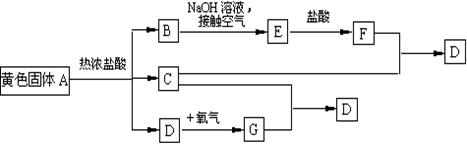
(1)A是 ,C是 ,F是 (均填化学式)。
(2)A与热盐酸反应的离子方程式为 ,
(3)写出该框图中由B→E的化学方程式 ,
。
四:计算题
21.(共8分)
某河道两旁有甲乙两厂.它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
(1)甲厂的废水中明显呈碱性,故甲厂废水中所含的三种离子是 、 、 。
(2)乙厂的废水中含有另外三种离子是 、 、 。
(3)有一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的
(填离子符号)转化为沉淀.经过滤后的废水主要含 ,可用来灌溉农田。
20.(共8分)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
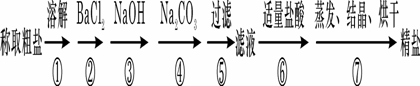
(1)判断BaCl2已过量的方法是 ____ __ ___________________________ _______。
(2)第④步中,相关的离子方程式 _____________________________________________ ____。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
_______________________________________________________
_______________________________________________________
_______________。
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,
上图是该同学转移溶液的示意图,图中的错误是
__________________________________________________。
19.(共13)
(A)实验室模拟合成氨和氨催化氧化的流程如下:
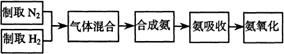
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和
氯化铵溶液经加热后反应制取氮气。
(1)从右图中选择制取气体的合适装置:
氮气 、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了
将气体混合外,还有 、
(3)氨合成器出来经冷却的气体连续通人乙装置的
水中吸收氨, (“会”或“不会”)发生倒吸,
原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式: 。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com