
题目列表(包括答案和解析)
15.(16分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是_________
A.40.32L B.30.24L C.20.16L D.6.72L
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,
请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子
方程式_____________________________________________________________。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L
(标准状况),则该气体的成分是__________________。则反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物
只有氯化铜和水。则在该反应中,H2O2是作用是_________剂,该反应的化学
方程式为 。
②乙同学提出,设计一个常见的实验装置,在一定条件下,不需再外加化学试
剂,就能将铜溶解在盐酸中。请写出该反应的化学方程式:
_____________________________________________,并画出相应的装置图。
14.(12分)工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2)。某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7)。实验流程为:
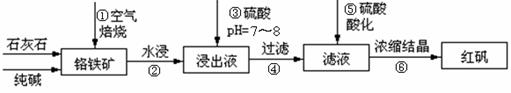
已知:焙烧时有如下反应发生:
① SiO2+CaCO3错误!嵌入对象无效。CaSiO3+CO2↑
② 4FeO·Cr2O3+8Na2CO3+7O2错误!嵌入对象无效。8Na2CrO4+2Fe2O3+8CO2↑
③ Al2O3与纯碱反应转变为可溶性盐,
(1)步骤①应将反应物装在 (填仪器名称)中焙烧;步骤④需要用到的玻璃仪器 ;焙烧时有1mol铬铁矿(FeO·Cr2O3)参与反应时电子转移数为 。
(2)步骤③用硫酸将溶液的pH调至7-8,目的是 。
写出有关的离子方程式 。
(3)将红矾与KCl固体1∶2(物质的量比)混合溶于水后经以下操作可得到K2Cr2O7晶体。下表中序号2、3、4的实验操作方法分别是:
操作2 、操作3 、操作4 。
|
序号 |
实验操作方法 |
实验操作过程 |
|
1 |
溶 解 |
将混合物放入烧杯中,加水,充分搅拌 |
|
2 |
操作2 |
将所得溶液沿玻璃棒引流至蒸发皿中,边加热边用玻璃棒搅拌溶液,使NaC1结晶析出 |
|
3 |
操作3 |
趁热将NaC1晶体与溶液分离 |
|
4 |
操作4 |
冷却滤液使K2Cr2O7析出 |
|
5 |
过 滤 |
得到K2Cr2O7晶体 |
13.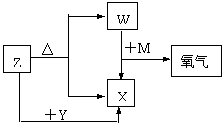 (13分)X、Y、Z、W、M五种化合物均由短周期元素组成,其中Z含有四种元素,X、Y、Z、M的焰色反应均为黄色,M为淡黄色粉末,可用于呼吸面具和潜水艇中氧气的来源,W为无色无味气体。这四种化合物具有下列转化关系(反应条件和反应中产生的水均已略去)。请回答:
(13分)X、Y、Z、W、M五种化合物均由短周期元素组成,其中Z含有四种元素,X、Y、Z、M的焰色反应均为黄色,M为淡黄色粉末,可用于呼吸面具和潜水艇中氧气的来源,W为无色无味气体。这四种化合物具有下列转化关系(反应条件和反应中产生的水均已略去)。请回答:
I.(1)M的电子式是 。写出M作供氧剂时发生反应的化学方程式(任写一个):________________________________________________________
(2)Z与Y在溶液中反应的离子方程式是 。
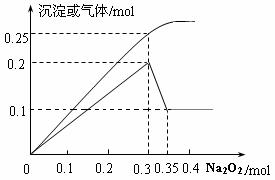 II.某无色透明溶液中可能含有
II.某无色透明溶液中可能含有
Fe3+、Mg2+、Cu2+、Al3+、NH4+,
加入Na2O2并加热,产生沉淀或
气体的物质的量与Na2O2的物质
的量关系如图所示。请回答:溶液中肯定没有__________离子;
沉淀部分减少时的离子方程式为_______________________________________。
III.某同学配制0.1mol·L-1的Na2CO3溶液,则在该溶液中,下列关系正确的_______
a.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1 mol/L
b.c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
c.c(Na+)+c(H+)=2c(CO32-)+c(HCO3-) +c(OH-)
d.c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
e.c(CO32-)+c(HCO3-)+c(H2CO3)=2 c(Na+)
12.(13分)科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
N2(g)+3H2O(1)==2NH3(g)+O2(g) ΔH= +765.2kJ·mol-1
回答下列问题:
I.请在答题纸中画出上述反应在反应过程中体系能量变化示意图,并进行必要标注。
II.请写出实验室制取氨气的化学方程式:
III.目前工业合成氨的原理是:N2(g)+3H2(g)\s\up8(20-50MPa20-50MPa500℃、铁触媒2NH3(g);△H<0。
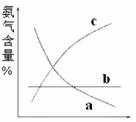 (1)右图表示随条件改变,氨气的百分含量的变化趋势。
(1)右图表示随条件改变,氨气的百分含量的变化趋势。
当横坐标为压强时,变化趋势正确的是(选填字母序
号,下同) ,当横坐标为温度时,变化趋
势正确的是 。
(2)在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60 mol H2(g),反应在一定 条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中各物质的物质的量之和的比)为。计算:
① 该条件下H2的平衡转化率为 ;
②
该条件下反应N2(g)+3H2(g)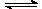 2NH3(g)的平衡常数K=
。
2NH3(g)的平衡常数K=
。
IV.(1)常温下氨气极易溶于水,其水溶液可以导电。请用方程式表示氨气溶于水且显弱碱性的过程: ;
(2)请你设计一个最简单可行的实验证明一水合氨(NH3·H2O)是弱电解质。
9.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对
下列实验事实解释正确的是
|
|
现 象 |
解 释 |
|
A |
浓HNO3在光照条件下变黄 |
浓硝酸不稳定,生成有色产物能溶于浓硝酸 |
|
B |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
向盐酸中加入浓硫酸时产生白雾 |
说明浓硫酸具有脱水性 |
8.在一定温度下,在a L的密闭容器中发生反应:4A(s)+3B(g)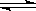 2C(g)+D(g),经2
min后B的浓度减少0.6
mol/L。对此反应的说法正确的是
2C(g)+D(g),经2
min后B的浓度减少0.6
mol/L。对此反应的说法正确的是
A.分别用B、C、D表示反应的速率,其比值是3∶2∶1
B.用A表示的反应速率是0.4 mol/(L·min)
C.容器内压强不随时间变化时标志着此反应达到平衡状态
D.在这2 min内用B和C表示的反应速率的值一定都是逐渐减小的
7.下列说法正确的是
A.第ⅠA族元素的金属性一定比第ⅡA族元素的金属性强
B.第ⅥIA族元素从上到下,其氢化物的还原性依次减弱
C.同周期从左到右,非金属元素最高价氧化物对应的水化物的酸性依次增强
D.第三周期元素的离子半径从左到右逐渐减小
6.在t℃时,将a gNH3完全溶解于水,得到VmL溶液。假设该溶液的密度为ρ g·cm-3,质量分数为ω,其中含NH4+的物质的量为b mol。下列叙述正确的是
A.溶质的质量分数ω =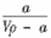 ×100%
×100%
B.溶质的物质的量浓度c = 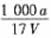 mol/L
mol/L
C.溶液中c(OH-)= 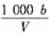 mol/L
mol/L
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
5.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是
A.氢气能氧化铜中的铜还原,铜能还原硝酸银溶液中的银,所以,氢气也能还原硝酸银溶液产生金属银
B.CO2与SiO2化学式相似,故CO2与SiO2的结构、性质也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.K与Na同主族并位于Na的下方,Na常温下能与水剧烈反应,故K常温下
也能与水剧烈反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com