
题目列表(包括答案和解析)
19.(8分)A、B、C、D、E、F六种中学常见的物质,
皆有短周期元素组成,有转化关系:
(1)若A、C、E皆为氧化物,且常温下A为无
色液体,E为有毒气体。
①B、D、F皆为非金属单质,且D为气体。
则A的结构式为 。
②B与C反应生成E和F的化学方程式为
(2)若B是由两种短周期元素组成的离子化合物,A、C为氧化物,E为气体单质,D、
F是均有三种元素组成的离子化合物,它们的水溶液均呈碱性,相同浓度时D溶液
的pH大于F。则:B和C反应生成E和F的化学方程式为 ,
列举该反应的一种用途 。
18.(10分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究
浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器以省略),请你
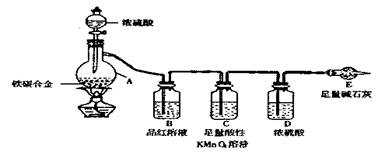 参与此项活动并回答相应问题。
参与此项活动并回答相应问题。
Ⅰ.探究浓硫酸的某些性质
(1)按图示的链接装置,检查装置的气密性,称量E的质量。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式 (任写一个)
B中的现象是 ,由此得到浓硫酸具有 性。
(3)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式:
(任写一个)
(4)反应一段时间后,从A中逸出气体的速率依然较快,除因温度较高,反映放热外,
还可能的原因是 。
Ⅱ.测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。
 铁碳合金中铁的质量分数为
铁碳合金中铁的质量分数为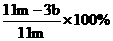 。
。
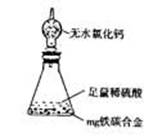
(6)某同学认为上述方法较复杂,使用下图所示的装置
和其它常用实验仪器测定某些数据即可。为了快速
和准确的计算出铁的质量分数,最简便的实验操作
是 (填写代号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、称量残渣的质量
 C.测定反应前后装置和药品的总质量。
C.测定反应前后装置和药品的总质量。
17.(6分)下列实验操作或对实验事实的描述不正确的是 (填序号)
①配置一定浓度的溶液时,俯视容量瓶的刻线,会使配置的浓度偏高。
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH) 3胶体。
③仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末。
④用磁坩埚熔化各种钠的化合物。
⑤实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入
少量铁粉。
⑥粗略测量溶液的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照;
⑦向NaOH溶液中滴加Al2 (SO4) 3溶液和向Al2 (SO4) 3溶液中滴加NaOH溶液现象不同。
⑧常温下,分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全
中和时,消耗的氢氧化钠溶液的体积前者少,后者多。
16.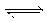 在密闭容器中,反应X2(g)+Y2(g)
2XY(g) △H<0,达到甲平衡时,再改变某一
在密闭容器中,反应X2(g)+Y2(g)
2XY(g) △H<0,达到甲平衡时,再改变某一
条件后,达到乙平衡,对此过程的分析正确的是 ( )
A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
第Ⅱ卷 (非选择题 共52分)
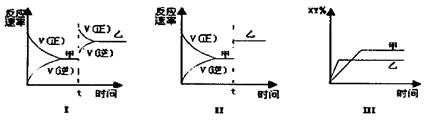
15. 2007年诺贝尔化学奖授予善于做“表面文章”的德国科
2007年诺贝尔化学奖授予善于做“表面文章”的德国科
学家格哈德·埃特尔。他的成就之一是证实了气体在固
体催化剂表面进行的反应,开创了表面化学的方法论。
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸
作用的过程如图所示。下列说法错误的是( )
A.NO和O2必须在催化剂表面才能反应
B.NO2是该过程的中间产物
 C.汽车尾气的主要污染成分包括CO和NO
C.汽车尾气的主要污染成分包括CO和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO 4CO+N2
14.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列事实
解释正确的是 ( )
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
|
B |
在潮湿的空气中,铁制品易生锈 |
铁、杂质碳和水膜形成了原电池 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
向盐酸中加入浓硫酸时产生白雾 |
说明浓硫酸具有脱水性 |
13.下列各图中的大黑点代表原子序数从1~18元素的原子实(原子实是原子除最外层电子
后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列
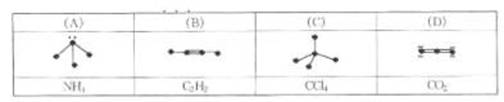 各图表示的结构与化学式一定不相符的是 ( )
各图表示的结构与化学式一定不相符的是 ( )
12.近日来,沈城“巨能钙”事件沸沸扬扬,原因在于部分巨能钙被检出含有双氧水,而双
氧水有致癌性,可加速人体衰老。因此卫生部已开始加紧调查“巨能钙”事件。下列有
关说法错误的是 ( )
A.双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害
B.H2O2、Na2O2中都存在非极性共价键
C.H2O2既有氧化性,又有还原性,与KMnO4反应时表现H2O2的还原性
D.H2O2做漂白剂是利用其氧化性,漂白原理与HclO类似,和SO2不同
11.纳米是长度单位,1纳米等于1×10-9m,物质的颗粒达到纳米级时,具有特殊的性质。
例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对
“纳米铜”的有关叙述正确的是 ( )
A.常温下“纳米铜”比铜片的金属性强,反应时反应速率快
B.常温下“纳米铜”比铜片更易失电子,反应时反应速率快
C.常温下“纳米铜”与铜片的还原性不同
D.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快。
10.下列关于热化学反应的描述中正确的是 ( )
A.盐酸和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和
热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则二氧化碳分解的热化学方程式为:
2CO2(g) =2CO(g)+O2(g) ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com