
题目列表(包括答案和解析)
7.将过量的气体通入到一种溶液中,一定能产生沉淀的是
①二氧化硫通入到硝酸钡溶液中 ②二氧化碳通入偏铝酸钠溶液中
③二氧化碳通入到氯化钙溶液中 ④氨气通入到AgNO3溶液中
A.只有①②③ B.只有①② C.只有①②④ D.只有②③
6.下列说法正确的是
A.由同一种元素形成的物质一定是纯净物
B.元素由游离态转化合态,一定被氧化
C.较活泼金属一定可以把较不活泼的金属从盐溶液中置换出来
D.金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物
5.在给定的四种溶液中,同时加入以下各种离子,可能在该溶液中大量共存的是
A.pH为1的溶液:Ca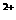 、Na
、Na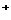 、Mg
、Mg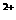 、NO3
、NO3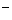
B.滴加石蕊试液显红色的溶液:Fe 、NH4
、NH4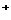 、Cl
、Cl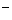 、SCN
、SCN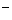
C.与铝反应放出氢气的溶液:K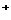 、HCO3
、HCO3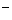 、Br
、Br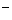 、Ba
、Ba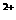
D.所含溶质为FeCl2的溶液:K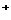 、SO4
、SO4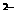 、NO3
、NO3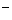 、H
、H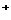
4.下列关于氧化物的叙述正确的是
①酸性氧化物肯定是非金属氧化物
②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物
④金属氧化物都是碱性氧化物
⑤酸性氧化物可与H2O反应生成相应的酸
⑥与H2O反应生成酸的氧化物不一定是酸性氧化物
⑦不能与酸反应的氧化物一定能与碱反应
A.①②③④ B.⑤⑥⑦ C.②③⑥⑦ D.③⑥
3.下列现象或应用中,不涉及胶体知识的是
A.清晨,在茂密的树林中,常常可以看到从枝叶间透过的道道光柱
B.用半透膜分离淀粉和食盐的混合液
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
2.下列仪器:①漏斗;②容量瓶;③蒸馏烧瓶;④托盘天平;⑤分液漏斗;⑥滴定管;⑦燃烧匙,其中常用于物质分离的是
A.①③④ B.①③⑤ C.①②⑥ D.①⑤⑦
1.在一定条件下,下列物质与硅、二氧化硅均不反应的是
A.氢氟酸 B.浓H2SO4 C.烧碱 D.氟气
21.(12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后
所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C1 |
0.2 |
pH=7 |
|
丙 |
0.1 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明
HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选
填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 ( )
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)不考虑其它组的实验结果,单从丙组实验结果分析,该混合溶液中离子浓度由大到
小的顺序是 。
(4)不考虑其它组的实验结果,单从丁组实验结果分析,所得混合溶液中由谁电离出的
c(OH-)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一
定要化简)。c(Na+)-c(A-)= mol/L
0.1mol·L-1W的水溶液的pH为13,Q的水溶液呈酸性,且物质的量浓度相同的
W、Q溶液中水的电离程度是前者小于后者。则:
W为 ,Q为 (填化学式)。
(5)用A单质和B单质可知趣气体燃料电池,该电池用多孔的惰性电极侵入浓KOH溶
液,两极分别通入A单质和B单质。写出该电池负极的电极反应式:
。
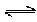 (6)已知工业合成X的反应方程式:D2 (g)+3B2 (g) 2X(g) △H=-92.4kJ/mol
(6)已知工业合成X的反应方程式:D2 (g)+3B2 (g) 2X(g) △H=-92.4kJ/mol
①在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率提高
D.达到化学平衡的过程中,气体平均相对分子质量减小
②某温度下,将10molD2,35molB2置于10L密闭容器中充分反应,15min达平衡,
反应放热为462kJ,计算:该温度下的平衡常数 。
20.(16分)A、B、C、D、E为五中常见的短周期元素,常温下,A、B可形成B2A2和B2A
两种液态化合物,B与D可组成分子X,也可组成阳离子Y,X、Y在水溶液中酸、碱
性恰好相反,C元素的焰色反应呈黄色,E与C同周期,且E的最高价氧化物的水化物
呈两性。试回答:
(1)D元素在周期表中的位置为 。
(2)B2A和X都是10电子化合物,它们的分子结合H+的能力不同,请用一个离子方程
式加以证明 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释
其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com