
题目列表(包括答案和解析)
1. 2008的北京奥运会主体育场--“鸟巢”,被《泰晤士报》评分为球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合成高新钢和
2008的北京奥运会主体育场--“鸟巢”,被《泰晤士报》评分为球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合成高新钢和
884块TEFE膜,并采用新一代的氮化镓铟高度
LED材料。有关说法正确的是 ( )
A.合金的熔点通常比组分金属高,硬度比给分
金属小
B.已知Ga处于IIIA族,可推知氮化镓化学式
为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂

 D.ETFE膜( [ CH2-CH2-CF2-CF2 ]n)是由两种单体缩聚而成的
D.ETFE膜( [ CH2-CH2-CF2-CF2 ]n)是由两种单体缩聚而成的
26.(6分)
将一块金属钠投入到100mLMgCl3和AlCl3的混合溶液中,发现沉淀先多后少。 反应完毕后收集到13.44L气体(标准状况下),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。
则原溶液中Mg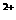 的物质的量浓度为 ;Al
的物质的量浓度为 ;Al 的物质的量浓度为 。
的物质的量浓度为 。
25.(4分)
Fe和Al是两种常见的金属,将它们按一定的质量比组成混合物。取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准标况下为aL,则反应的化学方程式为 ;混合物中Al的物质的量为 (用含字母的数学式表示)。
24.(8分)
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是 ;其中的B和D在电子工业上有着举足轻重的作用,试分别说出它们的一项重要用途,B ,D 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ,其中检验C溶液中含有A元素离子的操作和现象是 。
23.(4分)
某一无色溶液,可能含有Na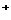 、Cu
、Cu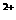 、NH4
、NH4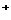 、Fe
、Fe 、Al
、Al 、Mg
、Mg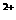 、CO3
、CO3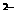 、SO4
、SO4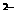 、K
、K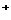 等离子中的一种或几种,为确定其组成,做如下实验:
等离子中的一种或几种,为确定其组成,做如下实验:
①取少量待测溶液,向其中滴入盐酸酸化的氯化钡溶液,生成白色沉淀;
②另取少量待测溶液,向其中加入过氧化钠,产生无色无味气体,并生成白色沉淀;加入过量过氧化钠时,沉淀部分溶解。
试判断:溶液中一定存在的离子有 ;一定不存在的离子有 。不确定的是 为验证此离子的存在,还应进行 实验。
22.(5分)
用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化法提纯。其反应式为:3C+2K2Cr2O7+8H2SO4===3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
(1)此反应的氧化剂是 ;lmol氧化产物中所含有的共价单键数目为 (阿伏加德罗常数用NA表示)。
(2)H2SO4在上述反应中表现出来的性质是 (填选项编号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(3)上述反应中若产生0.2mol CO2气体,则转移电子的个数是 (结果保留2位有效数字)。
21.(18分)
长期存放的Na2SO3会被空气中的氧气部分氧化:某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。
(Ⅰ)甲同学设计了下图实验
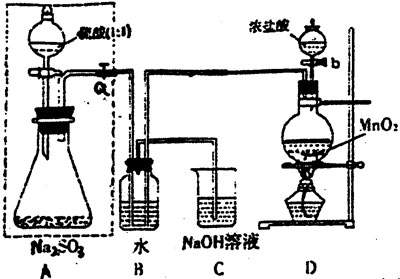
请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应如何检查虚线框内装置的气密性?
(2)写出B装置中的离子方程式 。
写出D装置中反应的化学方程式 。
(3)称量agNa2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaCl2溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀bg,则样品中Na2SO3的质量分数为 。
(4)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
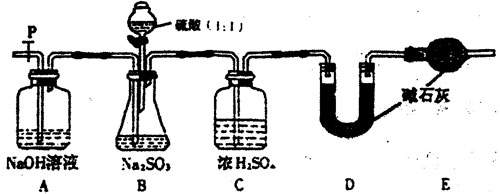
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 处,(填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液。
丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数。
下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaCl2溶液,过滤、洗涤、干燥、称量得沉淀mlg
B.将样品溶解,加足量硝酸,再加足量BaCl2溶液、过滤、洗涤、干燥、称量得沉淀m2g
C.将样品溶解,加过量BaCl2溶液,过滤后将溶液蒸干,称量得固体m3g
D.将样品溶解,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤,洗涤、干燥,称量得固体m4g。
20.(5分)按要求填空:
(1)用已经称量好的10.0g NaOH固体配制1.0 mol·L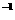 氢氧化钠溶液250mL,所需要的仪器为量筒和
。(2分)
氢氧化钠溶液250mL,所需要的仪器为量筒和
。(2分)
(2)除去KCl溶液中的SO4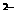 ,依次加入的试剂为(填化学式) 。
,依次加入的试剂为(填化学式) 。
19.(4分)
 化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
(1)在盛放浓硫酸的试剂瓶的标签上印有如右图所示警示标志,说明浓硫酸是一种 。
(2)下列有关实验操作和安全事故处理错误的有 。
a.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉的广口瓶中
b.用试管夹从试管底由下往上夹住距管口约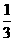 处,手持试管夹长柄进行加热
处,手持试管夹长柄进行加热
c.把用氯酸钾制氧气后的残渣倒入垃圾桶
 d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石
d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石
e.配制硫酸溶液时,在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
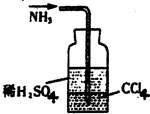
f.用右图所示装置吸收氨气
18.由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少一部分。将上述混合物在空气中加热,有气体放出,下列判断正确的是
A.混合物中一定不含有Na2CO3、NaCl B.混合物中一定有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3 D.混合物中一定不含Na2O2、NaCl
第Ⅱ卷(非选择题 共54分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com