
题目列表(包括答案和解析)
23.(10分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而
形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性
质。
[提出问题]Na2S2O3是否与Na2SO4相似而具备下列性质呢?
猜想①:溶液呈中性,且不与酸反应;
猜想②:无还原性,不能被氧化剂氧化
[实验探究]基本上述猜想①②,设计实验方案。
|
|
实验操作过程 |
实验现象或预 期实验现象 |
现象解释(用离子方程式表示) |
|
猜想① |
|
溶液pH=8 |
 |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O32-+2H+===S↓+SO2↑+H2O |
|
|
猜想② |
向新制氯气(pH<2)中滴加少量Na2S2O3溶液 |
氯气颜色变浅 |
|
[实验结论]Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似
[问题讨论]
(1)甲同学取探究“猜想②”反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀,
并据此认为氯气可将Na2S2O3氧化。你认为该方案是否合理并说明理由 。
(2)若方案不合理,请你设计一个实验方案,证明Na2S2O3被氯气氧化 。
22.(10分)(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的元酸)和NaOH溶
液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
|
实验编号 |
HA的物质的量浓度 (mol·L-1) |
NaOH的物质的量浓度 (mol·L-1) |
混合后溶液的pH |
|
甲 |
0.1 |
0.1 |
pH=a |
|
乙 |
0.12 |
0.1 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? 。
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系 。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中粒子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1
 (Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B====H++HB- HB- H++ B2-
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+ c(HB-)=0.1mol/L B.c(B2-)+ c(HB-)+ c(H2B)=0.1mol/L
C.c(OH-)= c(H+)+ c(HB-) D.c(Na+)+c(OH)=c(H+)+c(HB-)
21.(10分)现有aA、bB、cC、dD、eE吴中短周期元素,A、B、C、D都是生命体不可缺少
的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d;B、D都有同素异形体。
人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中大多都含有A、
B两种元素。E是一种生活中常用的金属。根据以上信息,回答下列问题:
(1)写出下列元素的名称:B 、C 。
(2)写出工业上制取E的化学方程式 。
(3)在A、B、D三种元素中选择两种或三种元素组成两种可以发生反应的阴离子,写
出该反应的离子方程式 。
(4)在A、B、D三种元素按照原子个数比4:1:1组成的化合物甲可与D单质构成燃
料电池,该电池用多孔的惰性电极侵入浓KOH溶液,两极分别通入化合物甲和D
单质,写出电池的负极反应式: 。
20.(7分)
①CaCO3(s)=CaO(s)+CO2(g) △H=177.7kJ
②C+H2O=CO+H2 △H=-131.3kJ.mol-1
③2S(g)+O2 (g)=2SO2 (g) △H1=a kJ.mol-1
④2S(s)+O2 (g)=2SO2 (g) △H2=b kJ.mol-1
⑤CO(g)+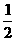 O2 (g)=CO2 (g) △H=-283kJ.mol-1
O2 (g)=CO2 (g) △H=-283kJ.mol-1
⑥C(s)+O2 (g)=CO2 (g) △H=-393.5kJ.mol-1
 ⑦N2 (g)+3H2
(g) 2NH3(g) △H=-92.4kJ.mol-1
⑦N2 (g)+3H2
(g) 2NH3(g) △H=-92.4kJ.mol-1
(1)上述热化学方程式中明显不正确的有 (填序号,下同)
(2)上述反应中表示燃烧热的热化学方程式的有 。
(3)比较△H1 △H2(选填“=”、“>”、“<”=
(4)根据上述信息,写出C燃烧转化为CO气体的热化学方程式 。
(5)对于反应⑦,在恒温恒压的条件下,三个容器中分别充入的气体和反应的焓变
(△H)如下表所示
|
容器 |
N2(mol) |
H2(mol) |
Ne(mol) |
△H |
|
甲 |
1 |
3 |
0 |
△H1 |
|
乙 |
2 |
6 |
0 |
△H2 |
|
丙 |
2 |
6 |
1 |
△H3 |
根据以上数据,下列叙述正确的是 。
A.△H1=-92.4kJ.mol-1 B.△H2=△H3<△H1
C.△H1>△H3>△H2 D.△H2=2△H1<△H3
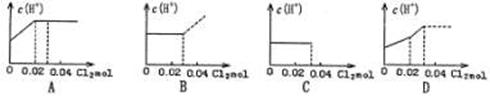
19.将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程溶液的
c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变) ( )
第Ⅱ卷 (非选择题 共55分)
18.右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是 ( )
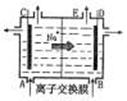 A.从E口逸出的气体是H2
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4LCl2,同时产生2molNaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制
时先加Na2CO3溶液
17.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制盐酸,流程复杂且造成浪费。
有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说
法错误的是 ( )
A.两极材料都用石墨,用稀盐酸作电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通入氯气的电极移动
D.通氯气的电极反应为Cl2+2e-===2Cl-
16. 在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C物质的浓度(c%)与温度、
在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C物质的浓度(c%)与温度、
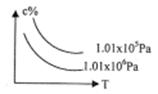 压强的关系如图所示,下列判断正确的是 ( )
压强的关系如图所示,下列判断正确的是 ( )
A.△H<0 △S>0
B.△H>0 △S<0
C.△H>0 △S>0
D.△H<0 △S<0
15.K35ClO3晶体与H37Cl溶液反应后,生成氯气、氯化钾和水,下列说法正确的是( )
A.氯化钾是还原产物
B.有两种元素的化合价发生了变化
C.被氧化的K35ClO3和被还原的H37Cl的物质的量之比为1:5
D.生成氯气的相对分子质量为73.3
14.A~D是含同一元素的四种物质,它们相互之间有如图所示的转化关系,其中A是单质,
D是其最高价氧化物对应的水化物,则A可能是 ( )
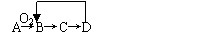
①Al ②Mg ③N2 ④S
A.①③ B.②③④ C.①②③ D.①②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com