
题目列表(包括答案和解析)
18.(12分)甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛含量不得超过0.08 mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
[测定原理]: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸
4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
[测定装置]:部分装置如下图所示
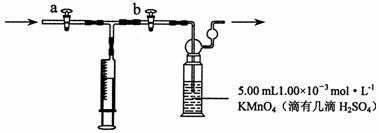
[测定步骤]:
(1)用 量取5.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20 mL稀释备用。
(2)将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用;
(3)打开a,关闭b, 用注射器抽取100 mL新装修的房屋室内空气。关闭 ,打开 (填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次;
(4)将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积;
(5)再重复实验2次,(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
[交流讨论]:
(1)计算该居室内空气中甲醛的浓度为 mg ·m-3,该居室的甲醛 (填“是”或“否”)超标;
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设称量或量取、溶液配制及滴定实验均无错误)提出合理假设: 、
。 (至少答出2种可能性);
(3)实验结束后,该小组成员在相互交流的过程中一致认为:
①实验原理可以简化
 实验中无需用草酸标准液滴定,可多次直接抽取室内空气,再压送到洗气瓶中,直至
实验中无需用草酸标准液滴定,可多次直接抽取室内空气,再压送到洗气瓶中,直至
;
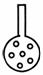
②实验装置应加以改进
可将插入KMnO4溶液的导管下端改成具有多孔的球泡(右图),有利于提高实
验的准确度,其理由是 。
17.(4分)下列实验操作或实验所得出的结论一定正确的是 (填序号)
A.加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成
B.制备Fe(OH)3胶体时,应往沸水中逐滴滴加1 mol·L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上与标准比色卡比较
D.仅用蒸馏水和pH试纸,不能鉴别pH相等的H2SO4和CH3COOH溶液
E.除去蛋白质中混有的少量NaCl,加入AgNO3溶液后过滤
F.在中和滴定中,用待测NaOH溶液润洗锥形瓶,测定结果将偏高
16.将pH=3的盐酸a L分别与下列三种溶液混合后,溶液均呈中性:
① 1×10-3 mol·L-1的氨水b L ② c(OH-)=1×10-3 mol·L-1的氨水c L
③ c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是
A.b>a>d>c B.b>a=d>c
C.a=b>c>d D.c>a=d>b
第Ⅱ卷(非选择题 共60分)
15.某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃-700℃,所用燃料为氢气,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2=2H2O,负极电极反应式为:
H2+CO32-
 H2O+CO2+2e-。则下列判断中正确的是
H2O+CO2+2e-。则下列判断中正确的是
A.放电时CO32-向负极移动
B.放电时CO32-向正极移动
C.正极反应: 4OH- 2H2O+O2↑+4e-
2H2O+O2↑+4e-
D.当电池中生成1 mol水时,转移4 mol电子
14.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成。则下列叙述不正确的是:
A.NH4H是离子化合物
B.NH4H固体投入少量的水中,有两种气体生成
C.NH4H与水反应时,NH4H是还原剂
D.NH4H溶于水,所形成的溶液显酸性
13.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
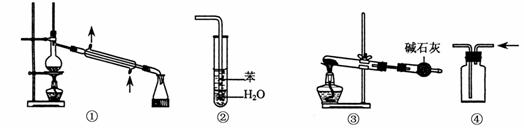
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④可收集CO2、H2等气体
12.一定温度下,在2L的密闭容器中加入4 mol A和6
mol B,发生如下反应:2A(g)+3B(g)
4C(g)+D(g),反应10 min后达到平衡,此时D的浓度是0.5 mol·L-1。下列说法正确的是
A.反应达平衡时c(B)=1.5 mol·L-1
B.前10 min内反应的平均速率υ(C)=0.1 mol·(L·min)-1
C.恒温下,将压强变为原来的2倍,则再次达平衡时D的浓度小于1 mol·L-1
D.10 min后向容器中加入A,再次达平衡时,A的转化率一定大于50%
10.下列说法中正确的是
A.同分异构体分子量相同,结构不同,化学性质一定相似
B.可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖
C.向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解
D.油脂、糖类和蛋白质是食物含有的主要营养物质,他们是高分子化合物
1125℃时,由水电离出的氢离子浓度c(H+)=1×10-13 mol·L-1的溶液中,一定不能大量共存的离子组是
A.Cl-、[Al(OH)4]-、Na+、K+ B.Fe3+、K+、NO3-、MnO4-
C.Fe2+、Ba2+、NO3-、Cl- D.SO42-、Cl-、Na+、K+
9.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同。则下列判断不正确的是
A.乙元素的族序数比甲元素的族序数大
B.甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙
C.原子半径由大到小的顺序为:丙>甲>乙
D.含乙元素的化合物数目比含甲或丙元素的化合物数目多
8.元素的性质包含金属性和非金属性,其强弱可以通过该元素对应的某些化学性质体现出来。某同学认为铝元素是金属元素,但是有一定的非金属性。下列化学反应中,你认为能支持该同学观点的是
A.铝片与盐酸反应生成氢气 B.氢氧化铝溶于强碱溶液
C.氢氧化铝溶于强酸溶液 D.铝热反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com