
题目列表(包括答案和解析)
1.化学与科技、生活、社会密切相关,下列说法正确的是
A.08年10月以后,北京小汽车仍将按车牌号限时行弛,提倡公民坐公交车,这体现了世界能源危机,符合节约型社会的需要。
B.08年10月8日瑞典皇家科学院将今年诺贝尔化学奖授予华裔科学家钱永键(中国导弹之父钱学森的堂侄)、日本科学家下村修和美国科学家马丁·沙尔菲三人,这体现了科学无国界,国际间也要注重科技合作、科技继承与创新。
C.08年6月1日(农历二〇〇八年四月二十八),我国开始实施 “限塑令”,在商场购物,顾客所要塑料袋需付费使用,目的是刺激货币流通,应对08年世界性“金融危机”。
D.三聚氰胺(C3N6H6)俗称“伪蛋白”、“蛋白精”,加入到奶粉中,目的是提高含氮量,即提高蛋白质的含量,口感舒适,便于饮用。
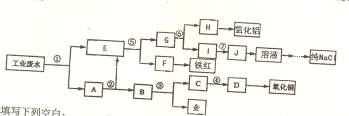
17.(14分)某厂的酸性工业废水中含有一定量的Na+, Al3+, Fe3+, Cu2+, Au3+ 5种阳离子和一种阴离子Cl- 。有人设计了图中的工艺流程图,利用常见的气体氧化物,酸,碱和工业生产中的废铁屑。从废水中回收金,并生产一定量的铁红,氧化物,氧化铝和NaCl晶体。
请填写下列空白:
(1)图中标号处需要加入的相应物质分别为
①__________②___________⑥__________⑦___________
(2)写出G→H处发生反应的离子反应方程式_____________________________________
(3)从环保角度考虑,③处应加入的试剂应为___________(填“稀硫酸”,“浓硫酸”);请
你将③处领设计一个既经济又环保的方案(只写出③处发生的反应化学方程式或离子方程式即可)。______________________________________________________________________
(4)①一⑥处都需要进行的相同的分离操作是_________________(填名称),用生产得到的
纯NaCl配制500mL4. 00m01/LNaCl溶液,所用仪器除药匙、玻璃棒外,还有
16.(11分)x、Y、Z、w为含有相同电子数的分子或离子,均由前两周期的元素组成,X有
5个原子核。通常状况下,w为无色液体。
已知:
(1)Z的化学式是_______________________________
(2)将aLZ通过灼热的装有铁触媒的硬质玻璃管后变为bL(气体体积均在同温同压下测定,b>a),在bL气体中,各物质的物质的量之比
n(____):n(____):n(_____)=_______:________:_______
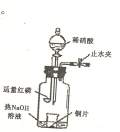 (3)用图示装置制备NO并验证其还原性。有下列主要
(3)用图示装置制备NO并验证其还原性。有下列主要
操作:
a. 向广口瓶内注入足量热NaOH溶液,将盛有铜片的小
烧杯放人瓶中。
b. 关闭止水夹,点燃红磷,伸人瓶中,塞好胶塞。
c. 待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧
杯中滴人少量稀硝酸。
①步骤c滴入稀硝酸后烧杯中的现象是_______________________________________-
反应的离子方程式是_____________________________________
②步骤c后还缺少的一步主要操作是________________________________________
③步骤c中能否用Na代替红磷,为什么?
15.(10分) 某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同
酸反应的差异及影响反应速率的因素。
实验药品:2. 0moL/L盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金
属用量均为9. 0g。
甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
|
4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比较连续的气泡 |
请回答:
(])写出铝与盐酸反应的离子方程式____________________________________
(2)反应1一15min内,铝与盐酸的反应速率逐渐加快,其原因是______________________
_______________________________________________________________
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些
假设或猜想(列出一种即可)?____________________________________________________
乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以
下实验设计表
|
实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L-1 |
|
1.
实验①和②探究盐酸浓度对该反应速率的 影响; 2. 实验①和③探究温度对该反应速率的影响; 3. 实验①和④探究金属规格(铝片,铝粉)对该反应速率的影响; |
① |
25˚C |
铝片 |
4. 0 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
14.(9分)I.在足量的氯化亚铁溶液中加入少量(1-2滴)液溴,振荡后溶液变为黄色。
(1)甲同学认为是Br2单质溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)请根据提供试剂作出判断:
试剂: A 酸性高锰酸钾溶液 B 氢氧化钠溶液 C 四氯化碳 D 硫氢化钾溶液
判断: 两个同学的观点中正确的是__________(填 “甲” 或 “乙”), 并用两种方法(原理不同)加以试验, 写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)若选用淀粉碘化钾溶液盘点哪位同学的推断正确,是否可行?若可行本问不需要回答, 若不可行请说明原因: _______________________________________________________
Ⅱ.若要把溶解于水中的Br2单质分离出来,所需要的主要玻璃仪器是____________, 该操作的名称是__________________________
13.(9分)某五色透明的溶液中可能含有下列离子: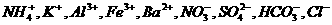 等,取该溶液进行如下实验:
等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;取溶液少许,滴人硝酸银溶液产生沉淀;
②取适量上述溶液,加入铜片和稀硫酸共热,排水收集到五色气体;
③取原溶液少许,滴人盛有氢氧化钡固体颗粒的试管中,颗粒完全溶解,产生白色沉淀,无气体产生;将该溶液分成等量的A、B两份;
④取A溶液,再加入氢氧化钡溶液后,沉淀不溶解。
⑤取B溶液,随着稀硝酸的加入,先有白色沉淀产生,后又溶解。
⑥取步骤③的白色沉淀,加入足量稀硝酸,沉淀不溶解;
请回答下列问题:
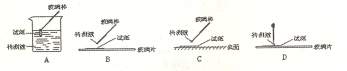
(1)在实验①中,下图所示的操作中正确的是__________(填代号)
(2)根据上述实验判断原溶液中肯定存在的离子是_________________________肯定不存在
的离子是____________________________________________________
(3)写出与①⑤两个实验有关的离子方程式
①_______________________________________________________________________
⑤_______________________________________________________________________
12.(9分)有短周期主族元素a、b、c、d、e、f、g六种元素,原子序数依次增大,其中a、b、c是前两周期元素,它们形成的常见化合物(甲)能抑制水的电离,b和c元素的原子组成的离子(乙)能促进水的电离,并且b、c元素在甲、乙中的化合价不变;d与c两元素不同周期,它们的单质在不同条件下能形成d2c(丙)和原子数之比为1:1的化合物(丁)与d同周期的金属e放人冷水中不反应,但再加入一定量的d单质后e单质溶解。
请回答下列问题
(])写出下列元素的符号:b: _____________c: ______________
(2)写出丁与二氧化碳反应的化学方程式,并标出电子转移____________________
(3)在周期表中相邻元素f和g中,g是短周期主族元素中原子序数最大的元素。这两种元素中非金属性较强的是___________-,(填元素符号),请你设计一个实验予以验证(只写出反应的离子方程式): ____________________________________________
11.(8分)氮化硅是一种新型陶瓷材料,它可由石英固体与焦炭颗粒在高温的氮气流中通
过如下反应:
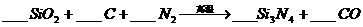
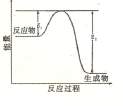
该反应过程中的能量变化如图所示,回答下列问题。
(1)上述反应中的还原剂是__________________,其还原产物是
 ______________________;
______________________;
(2)请配平上述反应方程式,并把配平后的系数填在对
应物质前的短线处;若反应中测得生成4.48LCO(标况
下)气体,则转移的电子数为____________
(3)该反应是______________(填“吸热”或“放热”),反应热△H__________0(填 “>” “<”或 “=”)
10.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形
象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: 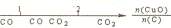
B. Fe在Cl2中的燃烧产物: 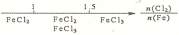
C. AlCl3溶液中滴加NaOH溶液后铝的存在形式: 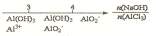
D.氨水与SO2反应后溶液中的铵盐: 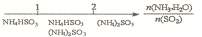
第Ⅱ卷 (非选择题 共70分)
9.在101kPa和25˚C时,有关反应的热化学方程式如下:( )
C(s)+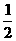 O2(g)=CO(g);△H1= -110 5kJ/mol
O2(g)=CO(g);△H1= -110 5kJ/mol
H2(g)+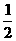 O2(g)=H2O(g);△H2= -241. 7kJ/mol
O2(g)=H2O(g);△H2= -241. 7kJ/mol
H2(g)+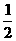 O2(g)=H2O(1);△H3= -285. 8kJ/mol
O2(g)=H2O(1);△H3= -285. 8kJ/mol
下列说法正确的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g);△H= -131. 2kJ/mol
B.H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2 H2O(1);△H= - 571. 6kJ/mol
C.2H2O(g)= 2H2(g)+O2(g);△H= - 483. 4kJ/mol
D.H2O(g)=H2O(1);△H= - 44. 1kJ/mo1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com