
题目列表(包括答案和解析)
21.黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:

在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度= n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量。试回答下列问题。
⑴写出在酸性介质中用NaClO3氧化FeSO4·7H2O的离子方程式。
⑵取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、
洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗
涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度。
⑶计算出该固体聚合硫酸铁样品的化学式。
命题、校对:徐新德

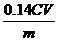 或
或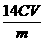 %
%
20.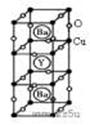 (10分)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡。凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘。钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
(10分)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡。凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘。钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
⑴给出铜在周期表中的位置(周期和族)
⑵写出Cu3+的核外电子排布:
⑶根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
⑷根据⑶所推出的化合物的组成,计算出其中Cu原子的平均化合价(该化合物中各元素的化合价为Y+3、Ba+2),最后计算化合物中这两种价态Cu原子个数比为:____________。
⑸在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有 和 。
19.(8分)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
(1)一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其模拟图如下。
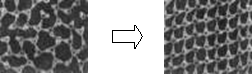
水 热冰
使水结成“热冰”采用“弱电场”的条件,说明水分子是 分子。请你展开想象,给“热冰”设计一个应用实例 。
(2)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是 。
②由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式 。
18.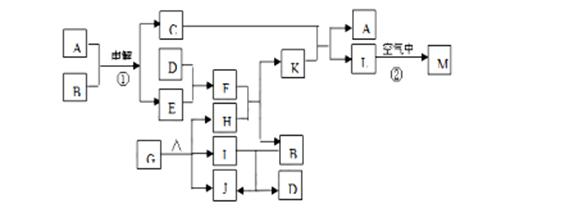 (12分)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物;C的焰色反应为黄色;M为有颜色的固体。
(12分)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物;C的焰色反应为黄色;M为有颜色的固体。
⑴写出:A的电子式 ,J的结构式 ,M的化学式 。
⑵基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
⑶写出K和E反应的离子方程式 。
写出F溶液和H反应的离子方程式 。
⑷已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为 。
17.(12分)⑴已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= mol·L-1。
⑵随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式 。
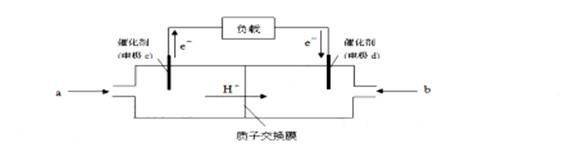 ②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质
子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。
16.(10分)用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌。同学们用制氢气的废液来制取皓矾(ZnSO4·7H2O),并探究其性质。 实验流程如下图所示:
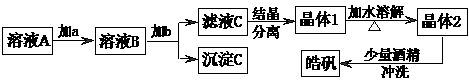
已知:氢氧化物沉淀的pH范围见右表。请回答下列问题:
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
5.7 |
|
完全沉淀pH |
3.7 |
9.6 |
8.0 |
① 加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
② 加入的试剂b,供选择使用的有: Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用 ,其理由是 。
③从晶体l→晶体2,该过程的名称是 。
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
⑤称取28.7g ZnSO4·7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见右表。则1000℃时皓矾的反应方程式为 。
|
温度(℃) |
60 |
240 |
930 |
1000 |
|
残留固体质量(g) |
19.7 |
16.1 |
8.1 |
8.1 |
15.I.(2分)下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号)。
A.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
B.制备氢氧化铁胶体时,应向沸水中逐滴滴加1-2 mL饱和的FeC13溶液,并继续加热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较
D.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
E.除去蛋白质溶液中混有的NaC1,可以先加入AgNO3溶液,然后过滤
F.在进行反应热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好反应、进行两到三次实验,取平均值
II.(8分)石灰石的主要成份是碳酸钙,含氧化钙约40~50%,较好的石灰石含CaO约45~53%。此外还有SiO2、Fe2O3、Al2O3及MgO等杂质。测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC2O4·H2O),将
所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量。涉及的化学反应为: H2C2O4 + MnO4- + H+ → Mn2+ + CO2 ↑+ H2O(未配平)。CaC2O4 沉淀颗粒细小,难于过滤。为了得到纯净而粗大的结晶,通常在含Ca2+的酸性溶液中加入饱和 (NH4)2C2O4 ,由于C2O42-浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中C2O42-浓度慢慢增大,可以获得颗粒比较粗大的CaC2O4沉淀。沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使CaC2O4溶解度太大。根据以上材料回答下列问题:
⑴样品溶于盐酸后得到的沉淀物主要是 (写化学式)
⑵沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
⑶工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
⑷若开始用去m g样品,最后滴定用去浓度为c mol/L 的KMnO4 溶液V mL,推出CaO含量与 KMnO4的定量计算关系。ω%=
14.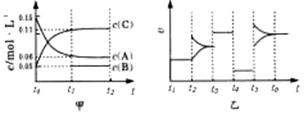 向某密闭容器中加入0.3 molA 、0.1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0-t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3-t4阶段为使用催化剂。下列说法正确的是:
向某密闭容器中加入0.3 molA 、0.1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0-t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3-t4阶段为使用催化剂。下列说法正确的是:
A.若 t1= 15 s,生成物C在 t0~ t1时间段的平均反应速率为0.004mol·L-1·s-1
B.t4 ~t5阶段改变的条件为降低反应温度
C.B 的起始物质的量为 0.02mol
D.t5 ~t6阶段容器内 A 的物质的量减少0 .03 mol ,而此过程中容器与外界的热交换总量为 akJ ,该反应的热化学方程式为3A (g)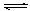 B(g)
+ 2C(g);ΔH=+100akJ·mol-1
B(g)
+ 2C(g);ΔH=+100akJ·mol-1
第二卷(非选择题 共72分)
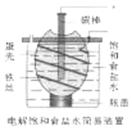
13.右图为电解饱和食盐水的简易装置,下列有关说法正确的是
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
12. 向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com